
科目: 来源: 题型:
下列叙述错误的是
A.用金属钠可区分乙醇和乙醚
B.用高锰酸钾酸性溶液可区分己烷和3--己烯
C.用水可区分苯和溴苯
D.用新制的银氨溶液可区分甲酸甲酯和乙醛
查看答案和解析>>
科目: 来源: 题型:
氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
根据题意完成下列计算:
⑴联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式。该氢化物受撞击则完全分解为氮气和氢气。4.30g该氢化物受撞击后产生的气体在标准状况下的体积为 L。
⑵联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水。
由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0kg水,计算推进剂中联氨的质量。
⑶氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为:6NO+ 4NH3=5N2+6H2O
6NO2+ 8NH3=7N2+12H2O NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156mol氮气。吸收后氨水密度为0.980 g/cm3。
计算:①该混合气体中NO与NO2的体积比。
②吸收后氨水的物质的量浓度(答案保留1位小数)。
⑷氨和二氧化碳反应可生成尿素CO(NH2)2。尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:

已知常压下120 mol CO(NH2)2在熔融状态发生缩合反应,失去80mol NH3,生成二聚物(C2H5N3O2)和三聚物。测得缩合产物中二聚物的物质的量分数为0.60,推算缩合产物中各缩合物的物质的量之比。
查看答案和解析>>
科目: 来源: 题型:
化合物M是一种治疗心脏病药物的中间体,以A为原料的工业合成路线如下图所示。
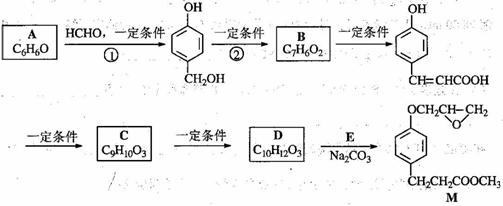
已知:RONa+ R’X→ROR’+ NaX
根据题意完成下列填空:
⑴写出反应类型。反应① 反应②
⑵写出结构简式。A C
⑶写出![]() 的邻位异构体分子内脱水产物香豆素的结构简式 。
的邻位异构体分子内脱水产物香豆素的结构简式 。
⑷由C生成D的另一个反应物是 ,反应条件是 。
⑸写出由D生成M的化学反应方程式 。
⑹A也是制备环己醇(![]() )的原料,写出检验A已完全转化为环己醇的方法。
)的原料,写出检验A已完全转化为环己醇的方法。
查看答案和解析>>
科目: 来源: 题型:
异丙苯(![]() ),是一种重要的有机化工原料。
),是一种重要的有机化工原料。
根据题意完成下列填空:
⑴由苯与2-丙醇反应制备异丙苯属于 反应;由异丙苯制备对溴异丙苯的反应试剂和反应条件为 。
⑵异丙苯有多种同分异构体,其中一溴代物最少的芳香烃的名称是 。
⑶α-甲基苯乙烯(![]() )是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到。写出由异丙苯制取该单体的另一种方法 (用化学反应方程式表示)。
)是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到。写出由异丙苯制取该单体的另一种方法 (用化学反应方程式表示)。
⑷耐热型ABS树脂由丙烯腈(CH2=CHCN)、1,3-丁二烯和α-甲基苯乙烯共聚生成,写出该树脂的结构简式 (不考虑单体比例)。
查看答案和解析>>
科目: 来源: 题型:
CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
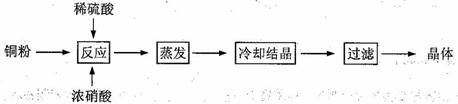
根据题意完成下列填空:
⑴向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象: 、 。
⑵如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4·5H2O中可能存在的杂质是 ,除去这种杂质的实验操作称为 。
⑶已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4
称取0.1000 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则0.1000 g该试样中含CuSO4·5H2O g。
⑷上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用 。
在滴定中,准确读数应该是滴定管上蓝线 所对应的刻度。
⑸如果采用重量法测定CuSO4·5H2O的含量,完成下列步骤:
① ②加水溶解③加氯化钡溶液,沉淀④过滤(其余步骤省略)
在过滤前,需要检验是否沉淀完全,其操作是
⑹如果1.040 g提纯后的试样中含CuSO4·5H2O的准确值为1.015 g,而实验测定结果是l.000 g 测定的相对误差为 。
查看答案和解析>>
科目: 来源: 题型:
实验室制取少量溴乙烷的装置如右图所示。根据题意完成下列填空:
⑴圆底烧瓶中加入的反应物是溴化钠、 和1:1的硫酸。配 制体积比1:1的硫酸所用的定量仪器为 (选填编号)。
a.天平 b.量筒 c.容量瓶 d.滴定管
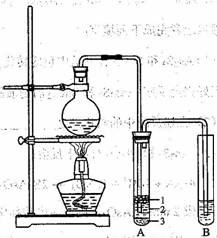 ⑵写出加热时烧瓶中发生的主要反应的化学方程 式 。
⑵写出加热时烧瓶中发生的主要反应的化学方程 式 。
⑶将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是 。
试管A中的物质分为三层(如图所示),产物在第 层。
⑷试管A中除了产物和水之外,还可能存在 、 (写出化学式)。
⑸用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是 (选填编号)。
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是 。
⑹实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是: 。
查看答案和解析>>
科目: 来源: 题型:
自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2(s) +4HF(g)![]() SiF4(g)+ 2H2O(g)+148.9 kJ
SiF4(g)+ 2H2O(g)+148.9 kJ
根据题意完成下列填空:
(1)在地壳深处容易有 气体逸出,在地壳浅处容易有 沉积。
(2)如果上述反应的平衡常数K值变大,该反应 (选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, (选填编号)。
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为 。
查看答案和解析>>
科目: 来源: 题型:
雄黄(AS4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 。
(2)上述反应中的氧化剂是 ,反应产生的气体可用 吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 (填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
查看答案和解析>>
科目: 来源: 题型:
工业上制取冰晶石(Na3AlF6)的化学方程式如下:
2Al(OH)3+ 12HF+ 3Na2CO3=2Na3AlF6+ 3CO2↑+ 9H2O
根据题意完成下列填空:
(1)在上述反应的反应物和生成物中,属于非极性分子的电子式 ,
属于弱酸的电离方程式 。
(2)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是
(选填编号)。
a.气态氢化物的稳定性 b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易 d.单质与同浓度酸发生反应的快慢
(3)反应物中某些元素处于同一周期。它们最高价氧化物对应的水化物之间发生反应的离子方程式为 。
(4) Na2CO3俗称纯碱,属于 晶体。工业上制取纯碱的原料是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com