
科目: 来源: 题型:
有关化学用语正确的是( )
① 羟基的电子式 ![]() ② 乙烯的结构简式:CH2CH2
② 乙烯的结构简式:CH2CH2
③硫化氢的电子式 H+![]() 2-H+ ④丙烷分子的球棍模型:
2-H+ ④丙烷分子的球棍模型: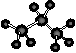
⑤ 苯分子的比例模型  ⑥甲烷的结构式 H
⑥甲烷的结构式 H![]() H
H
A.①④ B.②③④ C.④⑤⑥ D.②③⑤
查看答案和解析>>
科目: 来源: 题型:
有机化学知识在生活中应用广泛,下列说法错误的是 ( )
A.利用天然气做燃料可以有效地减少“温室效应”的气体产生
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分
C.可以用浸泡过高锰酸钾溶液的硅土来吸收水果或花朵产生的乙烯,达到保鲜目的
D.从石油中可以获得乙烯,乙烯是一种重要的基本化工原料
查看答案和解析>>
科目: 来源: 题型:
![]() 是γ射线放射源,可用于农作物诱变育种,我国用该方法培育出了许多农作物新品种,下列叙述正确的是
是γ射线放射源,可用于农作物诱变育种,我国用该方法培育出了许多农作物新品种,下列叙述正确的是
A.60是Co元素的相对原子质量
B.由Co的不同种同位素组成的单质,其化学性质与物理性质均不同
C.60是![]() 这种核素的质量数
这种核素的质量数
D.![]() 原子中,中子数是27,电子数是33
原子中,中子数是27,电子数是33
查看答案和解析>>
科目: 来源: 题型:阅读理解
工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为
CO(g)+2H2(g)![]() CH3OH(g)△H
CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250°C | 300°C | 350°C |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断△H 0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得
c(CO)=0.2mol/L,则CO的转化率为 ,此时的温度为 。
(2)在100℃ 压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的的平衡常数K= (用含a、V的代数式表示并化简至最简单的形式)。此时保持温度容积不变,再向容器中充入a mol CH3OH(g),平衡_____(向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数 。(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是 。
A.升温 B.加入催化剂 C.增加CO的浓度
D.恒容充入H2 E.恒压充入惰性气体 F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同) 。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2moL H2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 的 数 据 | CH3OH浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
请选择正确的序号填空(不定项选择)
① c1、c2、c3的关系表达正确的为______
A c3>2c1 B c1<c3<2c1 C c1=c2
② a、b、c的关系表达正确的为________
A c<2|△H| B a+b=|△H| C c=2b
③ p1、p2、p3的关系不正确的为________
A p1=p2 B p2<p3<2p2 C p3>2p2
④ a1、a2、a3的关系表达不正确的为________
A a1=a2 B a3< a2 C a1+a2=1
查看答案和解析>>
科目: 来源: 题型:
Ⅰ 某温度下,密闭容器中充入1 mol N2和3 mol H2,使之反应合成NH3,平衡后,测得NH3的体积分数为w,如果温度不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为w,N2、H2、NH3的物质的量分别用x、y、z表示.
(1)恒温恒容条件下:若x=0.75 mol, 则y=________, z=________.
(2)恒温恒压条件下,x、y、z(均不小于0)满足的一般条件是_______________________.
Ⅱ 一定条件下,可逆反应X(g)+Y(g) ![]() 2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y) =0.1 mol /L ; c (Z)=1.6 mol /L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是________ ____, a的取值范围为_______________
2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y) =0.1 mol /L ; c (Z)=1.6 mol /L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是________ ____, a的取值范围为_______________
Ⅲ 在10℃和4×105Pa的条件下,当反应aA(g) ![]() dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:
dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:
| 压强(Pa) | 4×105 | 6×105 | 10×105 | 20×105 |
| D的浓度(mol/L) | 0.085 | 0.126 | 0.200 | 0.440 |
(1)压强从4×105Pa增加到6×105Pa时,平衡向 (填“正”或“逆”)方向移动,理由是_________________________________________________________________
(2)压强从10×105Pa增加到20×105Pa时,平衡向_______(填“正”或“逆”)方向移动
查看答案和解析>>
科目: 来源: 题型:
有铜片、锌片和250mL稀硫酸组成的原电池,当在铜片上放出4.48L(标准状况下)的气体时,硫酸恰好完全反应。
(1)该原电池的正极反应式
(2) 原稀硫酸的物质的量浓度是 mol/ L
(3)锌片减少的质量
查看答案和解析>>
科目: 来源: 题型:
现有10种元素的性质、数据如下表所列,它们均为短周期元素。
|
| A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 0.102 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
回答下列问题:
(1)D的元素名称是 ,
H的元素符号是 。
B在元素周期表中的位置是(周期、族)
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是 。
化合物F2A2的电子式是: ,构成该物质的化学键类型为________________
(3)用电子式表示A的简单氢化物的形成过程如下: ;
G的氢化物的结构式为 。
(4)一定条件下,IA2气体与足量的A单质充分反应生成20g气态化合物,放出24.6 kJ热量,写出其热化学方程式 。
(5)用J元素的单质与A元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入J的单质,乙极通入A的单质,则甲极的电极反应式为:____________________。
查看答案和解析>>
科目: 来源: 题型:
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(△H)。
| 化学键 | Cl-Cl | H—H | H—Cl | N≡N |
| 键能/kJ·mol | 243 | 436 | 431 | 946 |
(1)按要求完成填空
a 2HCl(g) = H2(g)+Cl2(g);△H=
b N2 (g)+3H2(g) = 2NH3(g) ΔH=-92 kJ/mol,则N—H键的键能是 kJ·mol
(2)1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式

(3) 已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2
③ H2O(g) = H2O(l) ΔH3
则CH3OH(l)+O2(g)= CO(g) + 2H2O(l)ΔH = (用含ΔH1、ΔH2、ΔH3的式子表示)
(4) 已知:2Al (s)+ 3/2O2(g)==Al2O3(s) △H= -1 644.3 kJ• mol-1
2Fe (s) +3/2O2(g)==Fe2O3(s) △H= -815.88 kJ• mol-1
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式
_____________________________。
查看答案和解析>>
科目: 来源: 题型:
某化学反应2A![]() B+D在四种不同条件下进行。B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行。B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验序号 | 温度 | 0min | 10min | 20min | 30min | 40min | 50min | 60min |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 |
依上述数据,下列选项错误的是:
A 在实验1中,反应在10至20 min时间内平均速率为0.013mol·(L·min)-1。
B 在实验2中,A的初始浓度c2=1.0 mol/L,反应经20 min就达到平衡,推测实验2中还可能隐含的条件是:使用了合适的催化剂。
C 设实验3的反应速率为v3,实验1的反应速率为v1,则v3>v1,且c3>1.0 mol/L
D 比较实验4和实验1,可推测该反应是放热反应
查看答案和解析>>
科目: 来源: 题型:
在元素周期表主族元素中。甲元素与乙、丙、丁三元素紧密相邻。甲、乙的原子序数之和等于丙的原子序数。这四种元素原子的最外层电子数之和为20。下列判断正确的是( )
A.原子半径:丙>乙>甲>丁
B.丁或甲与乙所形成的化合物都是有毒的物质
C.最高价氧化物的对应水化物的酸性:丁>甲
D.气态氢化物的稳定性:甲>丙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com