
科目: 来源: 题型:
3.84克铜与足量的浓硫酸在加热条件下充分反应。
(1) 求生成的气体在标准状况下的体积是多少?
(2) 求被还原的硫酸的物质的量是多少?
(3) 将生成物稀释到500mL,求所得溶液中CuSO4的物质的量浓度是多少?
查看答案和解析>>
科目: 来源: 题型:
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有_________________________________________;
__________________________________________。
(2)加入硫酸铜溶液后可以加快氢气生成速率的原因是_____________________________。
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________。
(4)要加快上述实验中氢气生成速率,还可采取的措施有___________________________
____________________________________________________________ (答两种即可)。
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验:
| 实验 混合溶液 | A | B | C | D | E | F |
| 4 mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1=__________,V6=__________,V9=________。
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色。
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因___________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
实验室常用下图装置制取氨气:请回答下列问题:
(1)写出图中带有编号的仪器名称a___________ b___________。
 (2)写出该实验中制取氨气的化学方程式:
(2)写出该实验中制取氨气的化学方程式:
_____________________________________________________。
(3)检验氨气是否收集满的方法是
______________________________________________________。
(4)不用排水法收集氨气的原因是:_________________________。__。
(5)试管口棉花的作用是:_________________________________。__。
查看答案和解析>>
科目: 来源: 题型:
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:
| 实验方案 | 实验现象 |
| ①用砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞。 ②向新制的H2S饱和溶液中滴加新制的氯水 ③钠与滴有酚酞试液的冷水反应 ④镁带与2mol/L的盐酸反应 ⑤铝条与2mol/L的盐酸反应 | A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 B.产生气体,气体可燃,溶液变浅红色 C.反应不十分强烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告
(1)实验目的: 。
(2)实验用品:仪器、材料: 略 药品: 略
(3)实验内容:用序号填写下表中的实验方案,并完成相关的离子方程式
| 实验方案 | 实验现象 | 有关离子方程式 |
| A | ||
| B | 不填 | |
|
| C | 不填 |
| D | 不填 | |
| E |
(4)实验结论:____________________________________________________。
(5)请用原子结构理论解释上述结论的原因___________________________
______________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)如图,若烧瓶是干燥的。当烧瓶口向上时,由A
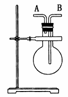 口导入气体,可收集下列中的 (填序号,下
口导入气体,可收集下列中的 (填序号,下
同)气体。若烧瓶充满水,可收集下列中的________气体。
①NO ②NH3 ③SO2 ④NO2
(2)若烧瓶中事先已集满一瓶氨气,并将烧瓶口向下放
置,由______口导入气体可收集NO气体,其原因是
__________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(1) 在这些元素中,化学性质最不活泼的是: (填元素符号)。
(2) 元素②和③非金属性较弱的是___________(填元素符号),画出元素③原子结构示意图_______________________。
(3) ④和⑧气态氢化物的稳定性较强的是_____________(填化学式)。
(4) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是___________,碱性最强的化合物的电子式是___________________。
(5)用电子式表示元素①和⑤所形成化合物的形成过程:________________________。
(6)⑤⑥⑦三种元素分别形成的单核离子半径由大到小顺序为________________(填离子符号)。
(7)元素①和④按原子个数比1:1形成的化合物分解的化学方程式_________________。
(8)写出元素⑦和⑨最高价氧化物的水化物之间反应的离子方程式_________________。
查看答案和解析>>
科目: 来源: 题型:
将充有m mL NO和n mL NO2的量筒倒立于水槽中,然后通入m mL O2,若m<n,则充分
反应后,量筒内气体体积的毫升数为
A.3(m-n) B.![]() C.m+
C.m+![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com