
科目: 来源: 题型:
红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据),根据下图回答下列问题:
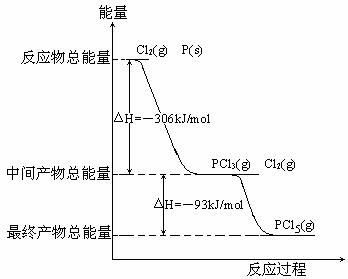
(1)PCl5分解生成PCl3和Cl2的热化学方程式 ;
上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解率α1等于 ;若反应温度由T1升高到T2,平衡时PCl5分解率α2,α2 α1 (填“大于”,“小于”或“等于”);
(2)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是 ;
(3)P和Cl2分两步反应生成1mol PCl5的△H3= 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
A、用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂
B、用待测定的溶液润洗酸式滴定管
C、用蒸馏水洗干净滴定管
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E、检查滴定管是否漏水
F、另取锥形瓶,再重复操作一次
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写) ;
②该滴定操作中应选用的指示剂是 ;
③在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果 (填“偏低”、“偏高”或“无影响”)。
(3)如有1mol/L和0.1mol/L的NaOH溶液,应用_____ _的NaOH溶液,原因是______________ ________。
 (4)用标准NaOH溶液滴定时,应将标准NaOH溶液注入下图中的 (选填“甲”或“乙”)中。
(4)用标准NaOH溶液滴定时,应将标准NaOH溶液注入下图中的 (选填“甲”或“乙”)中。
(5)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值 (填“偏低”、“偏高”或“无影响”)
(6)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度 (计算结果到小数点后二位)。
查看答案和解析>>
科目: 来源: 题型:
氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程示意图如下所示,完成下列填空:

(1)在电解过程中,与电源正极相连的电极上电极反应为__________________,与电源负极相连的电极附近,溶液pH_________(选填“不变”、“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为_________
_______________________________________________________________。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是_________。
a. Ba(OH)2 b. Ba(NO3)2 c. BaCl2
(4)为了有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为_________(选填a、b、c)
a. 先加NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂,再加Na2CO3
c. 先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过_________、冷却、_________(填写操作名称)除去NaCl。
查看答案和解析>>
科目: 来源: 题型:
某温度下,重水D2O的离子积为1.6×10-15,若用pH一样的定义来规定pD=-lgc(D+),以下关于pD的叙述正确的是 ( )
A.中性溶液的pD=7.0.
B.含0.01 mol的NaOD的D2O溶液1L,其pD=12.0.
C.溶解0.01 mol的DCl的D2O溶液1L,其pD=2.0.
D.在100 mL 0.25 mol·L-1的DCl重水溶液中,加入50 mL 0.2mol·L-1的NaOD的
重水溶液,其pD=1.0.
查看答案和解析>>
科目: 来源: 题型:
将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
A.c (HCN)<c (CN-) B.c (Na+)>c (CN-)
C.c (HCN)-c (CN-)=c (OH-) D.c (HCN)+c (CN-)=0.1mol·L-1
查看答案和解析>>
科目: 来源: 题型:
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是
A.在熔融电解质中,O2-由负极移向正极
B.通入丁烷的一极是负极,电极反应为:2C4H10+52e-+26O2- =8CO2+10H2O
C.通入空气的一极是负极,电极反应为:O2+4e-=2O2-
D.电池的总反应是:2C4H10+13O2 ® 8CO2+10H2O
查看答案和解析>>
科目: 来源: 题型:
对于平衡体系:mA(气)+nB(气) ![]() pC(气)+qD(气) △H <0,下列判断正确的是
pC(气)+qD(气) △H <0,下列判断正确的是
A.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.48倍, 则m+n>p+q
B.若平衡时,A、B的转化率相等,说明反应开始时A、B的物质的量之比为m:n
C.若平衡体系共有气体a mol,再向其中加入b molB物质,当重新达到平衡时,气体的 物 质的量等于(a+b)mol , 则m+n=q+p
D.温度不变时,若压强增大为原来的2倍,达到新平衡时,总体积一定比原体积的1/2 要小
查看答案和解析>>
科目: 来源: 题型:
在一个固定体积的密闭容器中,加入2molA和1molB发生以下反应:2A(g)+B(g) ![]() 3C(g)+D(g),达到平衡时C的浓度为W moll/L。若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡时,D的浓度为W/3 moll/L的是
3C(g)+D(g),达到平衡时C的浓度为W moll/L。若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡时,D的浓度为W/3 moll/L的是
A.3molC+1molD
B.2molA+2mol C
C.2molA+1moB+0.5molD
D.1molA+0.5molB+1.5molC+0.5molD
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com