
科目: 来源: 题型:
设NA为阿伏加德罗常数,下列说法中正确的是( )
A. 标准状况下2.24LH2O的分子个数为1NA
B. 11克CO2的分子个数为0.25NA
C. 1L浓度为0.1mol/L的MgCl2溶液中Cl-为0.1NA
D. 标准状况下2.24LNO2中原子个数为0.2NA
查看答案和解析>>
科目: 来源: 题型:
某研究性学习小组欲利用所学知识制备并提纯硫酸铜。所用原料为废旧铜材(含铁约2%,其它杂质忽略不计),过程如下:
I:制备硫酸铜
装置如右图, 写出阳极发生的电极反应式 ▲ 、
写出阳极发生的电极反应式 ▲ 、
▲ 。
II:提纯硫酸铜
待反应结束后,取出电极,按照如下流程提纯得到硫酸铜晶体(CuSO4·5H2O)
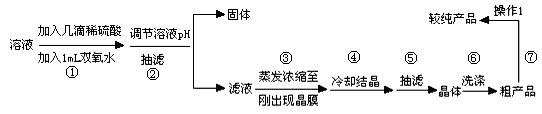
已知此溶液中Fe2+、Fe3+、Cu2+形成氢氧化物的pH如下表
离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe2+ | 6.4 | 8.4 |
Fe3+ | 2.4 | 3.1 |
Cu2+ | 5.2 | 6.5 |
(1)写出步骤①发生反应的离子方程式 ▲ 。
(2)步骤②中可加入 ▲ (填化学式)调节溶液pH至 ▲ (填范围)。
(3)步骤③不能蒸干的原因是 ▲ 。
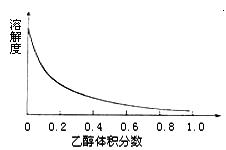 (4)右图表示硫酸铜晶体在乙醇水混合溶剂中溶解度随乙醇体积分数的变化曲线,则最适合作为步骤⑥洗涤液是 ▲ 。
(4)右图表示硫酸铜晶体在乙醇水混合溶剂中溶解度随乙醇体积分数的变化曲线,则最适合作为步骤⑥洗涤液是 ▲ 。
A.无水乙醇 B.蒸馏水
C.95%乙醇溶液 D.饱和硫酸钠溶液
(5)操作1的名称是 ▲ 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
从今年3月16日下午开始,大陆“海水受日本核辐射污染,碘可防辐射”等消息疯传,从绍兴、宁波、台州地区开始出现抢盐潮,接着蔓延到多个城市,人们抢购加碘盐是因为食盐中添加了碘元素。
I.人们在即将受到核辐射前的24小时内,需在医生指导下服用碘片,成人推荐服用量为100mg碘,假设此碘盐碘元素含量为40 mg/kg,要达到上述碘含量要求,需服用该碘盐 ▲ kg,你觉得服用碘盐防辐射合理吗? ▲
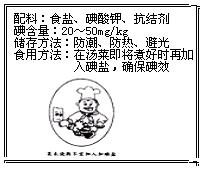 II.右图为某加碘盐标签的一部分。
II.右图为某加碘盐标签的一部分。
已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
②I2+2Na2S2O3=2NaI+Na2S4O6(无色)
某同学欲测定此加碘盐中碘元素的含量,进行以
下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移
至锥形瓶中,加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄色,再加入3滴淀粉溶液。
 步骤2:取一支50mL碱式滴定管,用bmol·L-1的新制Na2S2O3 溶
步骤2:取一支50mL碱式滴定管,用bmol·L-1的新制Na2S2O3 溶
液润洗2~3次后,装满溶液,调节液面高度至0刻度。
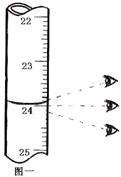
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:
| 编号 | 碱式滴定管读数 | 消耗体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 0 | 如图一 | |
| 2 | 0 | 23.98 | 23.98 |
| 3 | 0 | 24.02 | 24.02 |
(1)第一次读数为 ▲ mL。
(2)滴定终点的判断方法 ▲ 。
(3)经过计算,此加碘盐碘元素的含量为 ▲ mg/kg(用包含a、b的最简表达式表示)。
(4)下列操作可能会导致测量结果偏低的是 ▲ 。
A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g
B.步骤1所配食盐溶液未完全转移至锥形瓶
C.步骤2中滴定管洗涤后未润洗
D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失
查看答案和解析>>
科目: 来源: 题型:
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上合成甲醇的反应原理为:CO(g) + 2H2(g) ![]() CH3OH(g) ΔH,
CH3OH(g) ΔH,
下表所列数据是该反应在不同温度下的化学平衡常数(K)。
|
②在300℃时,将2 mol CO、3 mol H2和2 mol CH3OH充入容积为1L的密闭容器中,此时反应将 ▲ 。
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH = -1451.6 kJ·mol-1
②2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ·mol-1
写出该条件下甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: ▲ 。
(3)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则负极的电极反应式为 ▲ ,随着反应的不断进行溶液的pH ▲ (填“增大”“减小”或“不变”)。
(4)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为 ▲ ;如果电解一段时间后NaCl溶液的体积为1L,溶液的pH为12(25℃下测定),则理论上消耗氧气的体积为 ▲ mL(标况下)。
查看答案和解析>>
科目: 来源: 题型:
CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸 ▲ 醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol·L-1的CH3COOH溶液与50mL 0.2mol·L-1的NaOH溶液混合,所得溶液呈 ▲ 性,原因 ▲ (用离子方程式表示)。
(3)已知某混合溶液中只含有CH3COO-、H+、Na+、OH-四种离子,且离子浓度大小关系为:c(CH3COO-)> c(H+)> c(Na+)> c(OH-),则该溶液中含有的溶质为 ▲ 。
(4)已知Ka(CH3COOH)= 1.76×10-5 ,Ka(HNO2)= 4.6×10-4,若用同浓度的NaOH溶液分别中和等体积且pH相等的CH3COOH和HNO2,则消耗NaOH溶液的体积关系为:前者 ▲ 后者(填“>,<或=”)
(5)已知25℃时,0.1mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠呈碱性,所以溶液的pH增大;乙同学给出另外一种不同于甲同学的解释,请你写出乙同学可能的理由 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
在恒容密闭容器中存在下列平衡:C(s)+H2O(g)![]() CO(g)+H2(g)。CO(g)的平衡物质的量浓度c(CO)与温度T的关系如右图所示。下列说法错误的是
CO(g)+H2(g)。CO(g)的平衡物质的量浓度c(CO)与温度T的关系如右图所示。下列说法错误的是
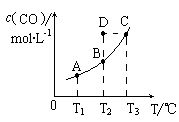
A.该反应的ΔH>0
B.若T1、T2时的平衡常数分别为K1、K2,则K1=K2
C.通过加热可以使B点变到C点
D.在T2时若反应进行到状态D,则一定有υ(正) <υ(逆)
查看答案和解析>>
科目: 来源: 题型:
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是:
| 实验 组别 | 反应 温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
科目: 来源: 题型:
下列各溶液中,相关微粒物质的量浓度关系不正确的是高
A.0.1 mol·L-1NH3•H2O溶液中: c (NH4+) < c (OH-)
B.0.1 mol·L-1 NH4Cl溶液中:c(NH4+)+c(H+)=c(Cl-)+c(OH-)
C.0.1 mol·L-1Na2CO3溶液中:c((HCO3-)+c(CO3-)+ c (H2CO3)= 0.1 mol·L-1
D.浓度均为0.1 mol·L-1的NH4Cl、CH3COONH4、NH4HSO4溶液,c(NH4+)大小顺序:CH3COONH4 > NH4Cl > NH4HSO4
查看答案和解析>>
科目: 来源: 题型:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如下图所示。下列说法不正确的是
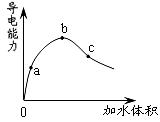
A.在0点时,醋酸不导电
B.a、b、c三点,a点时醋酸溶液中H+浓度最小
C.b点时,醋酸电离程度最大
D.可通过微热的方法使c点溶液中c(CH3COO-)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com