
科目: 来源: 题型:
工业上由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
|
(1)聚合物F的结构简式是 ;
(2)D转化为E的化学方程式是 ;
A转化为B的反应类型是 。
(3)在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式是 。
(4)E有多种同分异构体,写出3种含有一个羟基、一个酯基的E的同分异构体的结
构简式: 、 、 。
![]() (5)已知:①RX+Mg RMgX,
(5)已知:①RX+Mg RMgX,
|
|
提示:①合成过程中无机试剂任选;②只选用本题提供的信息和学过的知识;③合成反应流程图表示方法示例如下:由乙醇合成二溴乙烷的反应流程图可表示为
| |||
|
![]()
![]() CH3CH2OH CH2=CH2 CH2BrCH2Br
CH3CH2OH CH2=CH2 CH2BrCH2Br
查看答案和解析>>
科目: 来源: 题型:
【物质结构与性质】X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题
(1)X、Y的元素符号依次为 、 :
(2)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键
。
查看答案和解析>>
科目: 来源: 题型:
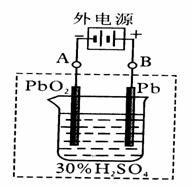
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- ![]() 2PbSO4+2H2O
2PbSO4+2H2O
回答下列问题(不考虑氢、氧的氧化还原反应)
(1)放电时:正极的电极反应式是 ;电解液中H2SO4的浓度将变________,当外电路通过1mol电子时,理论上负极板的质量增加 g。
(2)在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成__________,B电极上生成________,此时铅蓄电池的正负极的极性将____________。
查看答案和解析>>
科目: 来源: 题型:
根据下列化合物:① NaCl ② NaOH ③ HCl ④ NH4Cl ⑤ CH3COONa
⑥CH3COOH ⑦ NH3•H2O ⑧H2O
请回答下列问题:
(1)NH4Cl溶液显 性,用离子方程式表示 ,其溶液中离子浓度大小顺序为 ;
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)= ;在pH=3的CH3COOH 溶液中,水电离出来的c(H+)= ;
(3)已知水存在如下平衡:H2O+ H2O![]() H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是 。
H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是 。
A. 向水中加入NaHSO4固体 B. 向水中加Na2CO3固体
C. 加热至100℃[其中c(H+) = 1×10-6 mol•L-1] D. 向水中加入 (NH4)2SO4固体
(4)若等浓度、等体积的②NaOH和⑦NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH相等,则 m n (填 “<”、“>”或“=”)。
(5)除⑧H2O外,若其余7种溶液的物质的量浓度相同,则这7种溶液按pH由大到小的顺序为:____________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)已知:
Fe(s)+1/2O2(g)=FeO(s) ![]()
2Al(s)+3/2O2(g)= Al2O3(s) ![]()
Al和FeO发生铝热反应的热化学方程式是
_____________________________________________________。
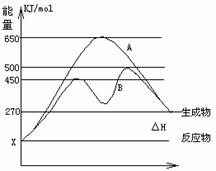 (2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
①据图判断该反应是_____(填“吸”或“放”) 热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率__ _ _ (填“增大”、“减小”或“不变”)
②其中B历程表明此反应采用的条件为______ (选填下列序号字母)
A、升高温度 B、增大反应物的浓度
C、降低温度 D、使用了催化剂
(3) 1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g) ![]() Na2S(s) + 4H2O(g) 。
Na2S(s) + 4H2O(g) 。
①该反应的平衡常数表达式为____________________。已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性_______ _____
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,请回答下列问题:
①混合溶液中水电离出的c(H+)与0.1mol·L-1NaOH溶液中水电离出的c(H+)比较
(填<、>、=)。
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填<、>、=);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为 。(填序号)
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
查看答案和解析>>
科目: 来源: 题型:
下列反应的离子方程式正确的有
A.碳酸氢钙溶液中加入足量的苛性钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
B.电解饱和食盐水:2Cl-+2H2OH2↑+Cl2↑+2OH-
C.氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-=3Cl-+ClO-+H2O
D.FeBr2溶液中通入足量的Cl2:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目: 来源: 题型:
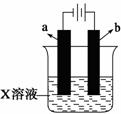
如下图所示,下列关于实验现象的描述正确的是( )
a电极 | B电极 | X溶液 | 实验现象 | |
A | 石墨 | 石墨 | CuCl2 | a电极质量增加,b电极放出无色气体 |
B | Fe | 石墨 | KNO3 | a电极质量增加,b电极放出无色气体 |
C | Fe | Cu | CuSO4 | a电极质量增加,b电极质量减少 |
D | 石墨 | 石墨 | HCl | A电极放出无色气体,b电极放出无色气体 |
查看答案和解析>>
科目: 来源: 题型:
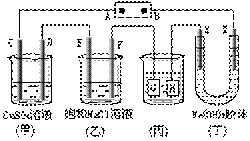
如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是
A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1 : 2 : 2 : 1
C.欲用(丙)装置给铜镀银,H极应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
查看答案和解析>>
科目: 来源: 题型:
近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:
KI + 3H2O
A.电解时,石墨作阴极,不锈钢作阳极
B.电解时,阳极反应是:I –+ 3H2O → IO3 – + 6H++ 6e –
C.溶液调节至强酸性,对生产有利
D.电解后溶液的pH明显减小
查看答案和解析>>
科目: 来源: 题型:
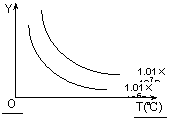
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下
发生反应建立的化学平衡:aA(g) + bB(g)![]() xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指 ( )
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指 ( )
 | |||
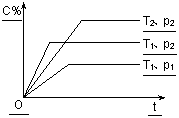 | |||
A.反应物A的百分含量 B.平衡混合气中物质B的百分含量
C.平衡混合气的密度 D.平衡混合气的平均摩尔质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com