
科目: 来源: 题型:
已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
(1)T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:
| 时间 / min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。则第4~5min之间,改变的条件 ,第5~6min之间,改变的条件是 。
(2)已知420℃时,该化学反应的平衡常数为9。如果反应开始时,CO和H2O(g)的浓度都是0.01 mol/L,则CO在此条件下的转化率为 。
(3)397℃时该反应的平衡常数为12,请判断该反应的△H (填“>”、“=”、“<”).
查看答案和解析>>
科目: 来源: 题型:
如图装置,A、B中电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极。若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电,则:
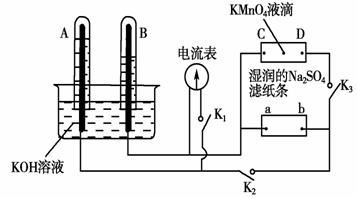
(1)标出电源的正、负极,a为 极。
(2)在湿的Na2SO4滤纸条中心的KMnO4液滴,有什么现象
(3)写出电极反应式:A中 。
(4)若电解一段时间,A、B中均有气体包围电极。此时切断K2、K3,闭合K1。电流表的指针偏转,则此时A极电极反应式为 。
查看答案和解析>>
科目: 来源: 题型:
工业制硫酸的核心反应是 :2SO2(g)+ O2(g)![]() 2SO3(g) △H<0,回答下列问题:
2SO3(g) △H<0,回答下列问题:
(1)此反应的平衡常数表达式为K= ,随着温度的升高,
上述平衡常数 (填“增大”、“减小”或“不变”)。
(2)将一定量的SO2(g)和O2(g)放入1L密闭容器中,在一定条件下达到平衡,测得SO2为0.11mol,O2为0.05mol,SO3为0.12mol。计算该条件下,反应的平衡常数K= 。
SO2的转化为SO3转化率= 。
(3)体积不变的条件下,下列措施中有利于提高SO2的转化率的是
(填字母)。
A.通入氧气 B.移出氧气 C.增大压强
D.减小压强E.加入催化剂
(4)工业制硫酸的尾气中含有少量SO2 ,可先用氨水吸收,再用硫酸处理。
①反应的化学方程式为 ,
②这样处理的优点是
。
查看答案和解析>>
科目: 来源: 题型:
(Ⅰ)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在空气酸度不大的环境中,其正极是 ,正极反应式为 。受空气的影响还会发生相应的颜色变化,其相应的化学方程式为
(Ⅱ)下列各情况,在其中Fe片腐蚀由快到慢的顺序是(用序号表示)
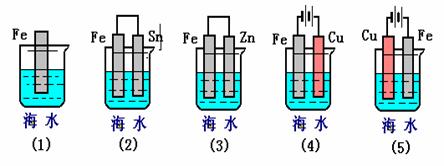
查看答案和解析>>
科目: 来源: 题型:
氮化硅是一种新型陶瓷材料,它可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应:
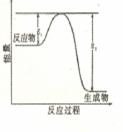 3SiO2+6C+2N2=
3SiO2+6C+2N2=![]() +6CO
+6CO
该反应过程中的能量变化如图所示,回答下列问题。
(1)上述反应中的还原剂是__________________,其还原产物是
______________________;
(2)若反应中测得生成4.48LCO(标况下)气体,则转移的电子数为____________
(3)该反应是______________(填“吸热”或“放热”),反应热△H__________0(填 “>” “<”或 “=”)
查看答案和解析>>
科目: 来源: 题型:
下列有关化学反应原理的应用叙述正确的是 ( )
A.用明矾净水是因为Al3+水解生成的Al(OH)3胶粒具有很强的吸附性
B.合成氨生成过程中,采用高温高压都是为了提高N2、H2转化率
C.往铁钉镀铜时,用铜做阴极
D.电解饱和食盐水制烧碱,NaOH在阳极区域产生
查看答案和解析>>
科目: 来源: 题型:
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为氢氧化钾溶液,其充放电按下式进行:Cd + 2NiO(OH) + H2O ![]()
Cd(OH)2 + 2Ni(OH)2 .下列有关电池的说法正确的是( ):
A.充电时阳极反应:Ni(OH)2 + OH- === NiO(OH) + H2O + e-
B.充电过程是化学能转化为电能的过程
C.放电时负极附近的溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目: 来源: 题型:
在可逆反应2SO2 + O2![]() 2SO3的平衡状态,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是(K为平衡常数)( )
2SO3的平衡状态,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是(K为平衡常数)( )
A. 平衡右移,K变大,O2转化率增大
B. 平衡右移,K变大,O2转化率减小
C. 平衡右移,K不变,O2转化率增大
D. 平衡右移,K不变,SO2转化率增大
查看答案和解析>>
科目: 来源: 题型:
可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①一个N N叁键断裂的同时,有3个H—H键断裂;②一个N N叁键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3%、N2%、H2%都不再改变;⑥恒温、恒容时,密度保持不变; ⑦正反应速率v(H2)=0.6 mol·(L·min)-1,逆反应速率v(NH3)=0.4 mol·(L·min)-1。( )
A.全部 B.①③④⑤ C.②③④⑤⑦ D.①③⑤⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com