
科目: 来源: 题型:阅读理解
I、二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。比Cl更好。
⑴ 在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水消毒,其主要原因是 。
⑵ 用ClO2处理过的饮用水(pH 5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2—)。
饮用水中的ClO2、ClO2—含量可用连续碘量法进行测定。ClO2被I—还原为ClO2—、Cl—的转化
率与溶液pH的关系如下图所示。当pH≤2 .0时,ClO2—也能被I—完全还原为Cl—。反应生成
的I2用标准Na2S2O3溶液滴定;2Na2S2O3+ I2= Na2S4O6 + 2NaI
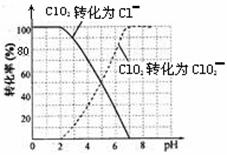 ①请写出pH≤2 .0时ClO2—与I—反应的离子方程式 。
①请写出pH≤2 .0时ClO2—与I—反应的离子方程式 。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4: 加入少量淀粉溶液,用c mol·L-1Na2S2O3
溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5: 。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
③根据上述分析数据,测得该饮用水中ClO2—的浓度为 mol·L-1(用含字母的代数式表示)。
II.(11分)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:

⑴ 在农业生产中,滤液1可用作 。
⑵ 流程中生成高铁酸钾的离子方程式是: ,控制此反应温度30℃以下的原因是: 。
⑶结晶过程中加入浓KOH溶液的作用是: 。
⑷某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是2:3,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 。
⑸实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如图1、图2所示。为了获取更多的高铁酸钾,铁盐的质量分数应控制在 附近、反应时间应控制在 。

查看答案和解析>>
科目: 来源: 题型:
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1) 工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)![]() H1
H1
反应Ⅱ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)![]() H2
H2
①上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”);
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断![]() H1 0(填“>”“=”或“<”);
H1 0(填“>”“=”或“<”);
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为 .
(2)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应Ⅰ进行甲醇合成,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
① 比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
② 若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4 mol·L-1,则该时间内反应速率v(CH3OH) = mol·(L·min)-1。
(3)生产过程中,合成气要进行循环,其目的是 。
查看答案和解析>>
科目: 来源: 题型:
下列A~K是中学化学中的常见物质,其中D、E、K为单质,其余物质为化合物。这些物质具有下列转化关系(省略了水和部分反应物及生成物),除反应②外,其他反应均在水溶液中进行。其中D是工业中最常用的金属。 回答:
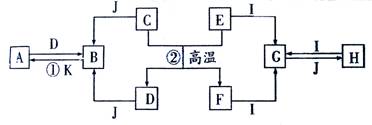
(1)A、H分别为 、 (填化学式)
(2)写出反应②的化学方程式 。
(3) 2.7克E与I完全反应生成G,若G与J反应生成3.9克不溶物H ,则消耗J的物质的量为 。
(4)若实验测得无水H在常压条件下不同温度时的密度为:
T(℃) | 200 | 600 | 800 |
ρ(g/L) | 6.881 | 2.650 | 1.517 |
气体摩尔体积(L/mol) | 38.8 | 71.6 | 88.0 |
则 600℃时无水H存在形式的分子式为 。
查看答案和解析>>
科目: 来源: 题型:
原子序数由小到大排列的四种短周期主族元素X、Y、Z、W, 其中Z、W两原子的核外电子数之和为X、Y两原子核外电子电子数之和的三倍,Y、Z左右相邻,Z、W位于同一主族。
(1)Y元素是 (填元素名称)。
(2)由X、Y、Z三种元素组成的盐中存在的化学键为 。
(3)解释WZ2的水溶液显酸性的原因 (用方程式表示)。
(4)某物质由Na、Y、Z三种元素组成,取该物质配成的溶液,滴加AgNO3溶液,有白色沉淀生成,再滴入稀HNO3,白色沉淀溶解,该物质的分子式为 。
(5)分别均由X、Y、Z、W四种元素组成的化合物A和B,它们之间能以物质的量1:1进行反应。写出A与B两溶液反应的离子方程式 。
(6)Y2X4是一种可燃性的液体,其燃烧产物之一是大气中的主要成分。1.60g Y2X4在氧气中完全燃烧放出热量31.2 kJ(25℃),请写出Y2X4完全燃烧的热化学反应方程式 。
查看答案和解析>>
科目: 来源: 题型:
)碳酸钙常用作牙膏的摩擦剂。某同学设计了一种制备碳酸钙的方案,其流程图如下。(所用石灰石含有杂质SiO2)
![]()
回答下列问题:
(1)充分煅烧110吨石灰石得到固体66吨,则石灰石中碳酸钙的质量分数为 %。
(2)假设第①步反应完全进行,则第②步反应过滤后得到的不溶液性滤渣的成分为
。
(3)第③步反应一般不采用通入CO2的主要原因是 ,相应的离子方程式为 。
(4)CaCO3是一种难溶液物质,25℃时其KSP=2.8×10-9。现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.0×10-4mol/L,则生成沉淀所需CaCl2溶液的物质的量浓度最小是 。
(5)某生用石灰石为原料,设计了另一种制备碳酸钙的实验方案,其流程图如下
![]()
与前一方案相比较,该方案的优点是 。
查看答案和解析>>
科目: 来源: 题型:
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是
A.原混合酸中NO3-物质的量为0.4 mol
B.原混合酸中H2SO4浓度为2.0 mol·L-1
C.第二份溶液中最终溶质为FeSO4
D. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气

查看答案和解析>>
科目: 来源: 题型:
120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是
A.2.0mol/L B.0.15 mol/L C. 1.8 mol/L D.0.24mol/L
查看答案和解析>>
科目: 来源: 题型:
甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中各含18个电子,甲是气态氢化物,在水中分步电离出两种阴离子,下列推断合理的是
A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
C.丁和甲中氢元素质量比相同,则丁中一定含有氧元素
D.丙中含有第2周期ⅣA族的元素,则丙一定是甲烷的同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com