
科目: 来源: 题型:
SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F 、S-F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g)=SF6(g)的反应热△H为
A. -1780kJ/mol B. -1220 kJ/mol C.-450 kJ/mol D. +430 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
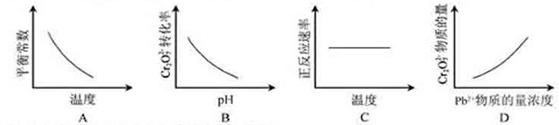
电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4):
Cr2O72-(aq)+2Pb2+(aq)+H2O(l)![]() 2 PbCrO4(s)+2H+(aq) ΔH< 0
2 PbCrO4(s)+2H+(aq) ΔH< 0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是[已知:pH= -lgc(H+) ]
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同
B.同温同压下,H2 (g)+Cl2(g)= 2HCl(g)在光照和点燃条件下的△H不同
C.已知:①2H2(g) +O2(g) =2H2O(g) △H=-a kJ·mol-1,
②2H2(g)+O2 (g)= 2H2O(1) △H=-b kJ·mol-1,则a>b
D.已知:①C(s,石墨)+O2 (g)=CO2(g) △H=- 393.5kJ·mol-1,
②C(s,金刚石)+O2(g)=CO2 (g) △H=- 395.0 kJ·mol-1,
则C(s,石墨)=C(s,金刚石)△H= + 1.5 kJ·mol-1。
查看答案和解析>>
科目: 来源: 题型:
将4 mol A和2 mol B放入2 L密闭容器中发生反应2A(g) + B(g) ![]() 2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
A.4 s内,υ(B)=0.075 mol/(L ·s)
B.当c(A)︰c(B)︰c(C)=2︰1︰2 时,该反应即达到平衡状态
C.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
查看答案和解析>>
科目: 来源: 题型:
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A (g)+xB(g)![]() 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确是
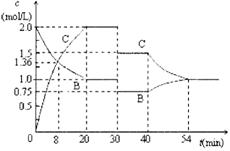
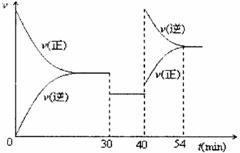
A. 8min时表示正反应速率等于逆反应速率
B.前20min A的反应速率为0.05mol/(L·min )
C.反应方程式中的x=1,30min 时表示增大压强
D.40min时改变的条件是升高温度,且正反应为吸热反应
查看答案和解析>>
科目: 来源: 题型:
已知:CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g) ΔH =-49.0 kJ?mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是
CH3OH(g) + H2O(g) ΔH =-49.0 kJ?mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是
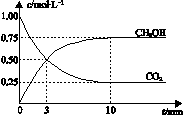 | |||
A.升高温度能使 ![]() 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于
用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率
υ(H2)=0.075 mol?L-1?min-1
查看答案和解析>>
科目: 来源: 题型:
下列热化学方程式正确的是(△H的绝对值均正确)
A.S(s)+O2(g)= SO2(g);△H=-269.8kJ/mol(反应热)
B.NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热)
C.C2H5OH(l)+3O2(g)= 2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热)
D.2NO2 = O2+2NO;△H = +116.2kJ/mol(反应热)
查看答案和解析>>
科目: 来源: 题型:
恒容密闭容器中,某化学反应2A ![]() B+D在四种不同条件下进行,B、D
B+D在四种不同条件下进行,B、D
起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验序号 | 浓度(mol/L) | 时间(min) | |||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | |||
| 1 | 温 度 | 8000C | 1.0 | 0.80 | O.64 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 8000C | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
| 3 | 8000C | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 | |
| 4 | 8200C | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 | |
根据上述数据,完成下列填空:
(1)在实验1,反应在前20min内用B的浓度变化来表示的平均速率
为 mol/(L·min)。
(2)在实验2,A的初始浓度c2= mol/L,反应在 20分钟内就达到
平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1(用同种物质的浓度变
化表示),则达到平衡时υ3 υ1(填>、=、<=)
且c3 = mol/L。
(4)比较实验4和实验1,可推测该反应是 反应(选填“吸热”、“放热”)。
(5) 800℃时,反应2A ![]() B+D的平衡常数= ,
B+D的平衡常数= ,
实验2中达到平衡时A的转化率= 。
查看答案和解析>>
科目: 来源: 题型:
20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图中信息,回答下列问题:
(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示
意图,请写出NO2和CO反应的热化学方程式__________________________________
在反应体系中加入催化剂,E1和E2的变化是:E1_________,E2________(填“增大”、“减小”或“不变”),对反应热是否有影响?_______________,
原因是_
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据)。根据图二回答下列问题:
① PCl5(g)分解成PCl3(g)和Cl2(g)的热化学方程式
② P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)
的△H2关系是:△H2______ △H1(填“大于”、“小于”或“等于”),原因是
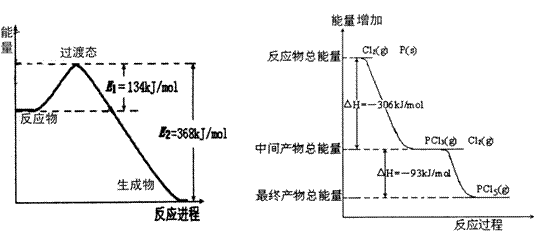
图一 图二
查看答案和解析>>
科目: 来源: 题型:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,
2NO2(g)体系中,
n(NO) 随时间的变化如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K= ,
已知:K(300℃)>K(350℃),该反应是 反应(填“放热”或“吸热”);
(2)右图中表示NO2的变化的曲线是 ,用O2的浓度变化表示从
0~2s内该反应的平均速率υ= ;
(3)能说明该反应已经达到平衡状态的是________________
a. υ(NO2)=2υ(O2) b.容器内压强保持不变
c.υ逆(NO)=2υ正(O2) d.容器内物质的密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是___________
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
(5)若将容器体积缩小至1L,反应达到平衡时的平衡常数 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com