
科目: 来源: 题型:
某学生运用将一粒金属钠和一块铜片分别放在表面皿中,研究它们在空气中的稳定性。该学生采用的研究方法有 ①假说法 ②实验法 ③分类法 ④比较法
A.①② B.①③ C.②④ D.①③
查看答案和解析>>
科目: 来源: 题型:
下列说法中,正确的是
A.化学的特征就是认识分子和制造分子
B.在任何条件下,1mol任何气体的体积都约是22.4L
C.在化学反应中,参加反应的各物质的质量比等于其物质的量之比
D.胶体就是微粒半径在1-100nm之间的物质,是纯净物。
查看答案和解析>>
科目: 来源: 题型:
生态农业涉及农家肥料的综合利用。某种肥料经发酵得到一种含有甲烷(CH4) 、二氧化碳、氮气的混合气体8.96L(标准状况)。该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:
CH4+CuO![]() CO2↑+H2O↑+Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入足量的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。
CO2↑+H2O↑+Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入足量的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。
(1) 用单线桥法标明CH4+CuO![]() CO2↑+H2O↑+Cu电子转移的方向和数目
CO2↑+H2O↑+Cu电子转移的方向和数目
(2) 原混合气体的物质的量是____________;(3)求原混合气体中甲烷及氮气体积。
查看答案和解析>>
科目: 来源: 题型:
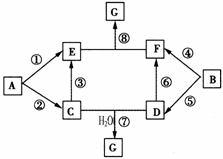
A-G的转化关系如图所示(部分反应物、产物和反应条件未标出)
已知:①A、B为中学化学常见的金属单质;C-G均为化合物,并且E和G均含有3种元素;②C是淡黄色固体,D既能与强酸溶液反应,又能与强碱溶液反应;③F溶液中加入AgNO3溶液产生不溶于稀硝酸的白色沉淀;④E和G焰色反应均呈黄色。
根据以上信息回答下列问题:
(1)写出物质G的化学式:
(2)①-⑥反应中,不属于氧化还原反应的是 ;
(3)反应③的离子方程式为 ;
(4)反应⑦对应的总化学方程式为 ;
(5)反应③中,若有31.2g C参加反应,转移电子的物质的量为 。
查看答案和解析>>
科目: 来源: 题型:
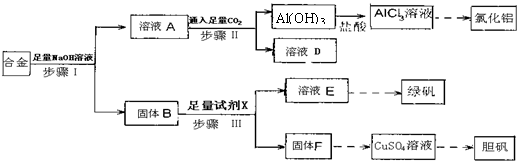
为探索工业废料的再利用,某化学兴趣小组设计了如下图所示实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
请回答:
(1)步骤I、II、III中均需进行的实验操作是 。
(2)溶液D中的离子主要有 ;试剂X是 。
(3)进行步骤II时,该小组用右图装置及试剂将制得的CO2通入溶液A中,一段时间后,观察到烧杯中产生的Al(OH)3沉淀逐渐减少,其原因是 (用离子方程式表示);为了避免Al(OH)3沉淀减少,根据右图所示,改进的措施是 。
(4)从氧化还原反应和环保角度考虑,用F制备CuSO4时需要氧气和硫酸共同参与,对应的化学方程式是 。

查看答案和解析>>
科目: 来源: 题型:
化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是 。
(2)“三酸”与“两碱”之间均可反应,酸过量时若用化学方程式表示有六个,若用离子方程式表示却只有两个,请写出其中能产生气体的离子方程式为 ;选取日常生活中常见物质由纯碱制烧碱的化学方程式为 。
(3)“三酸”常用于溶解金属和金属氧化物。下列块状金属不能溶于足量浓盐酸的是 。
A. Fe B.Cu C.Al D. Ag
(4)烧碱、纯碱均可吸收CO2,当含0.1molNaOH的溶液吸收一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况,分别是:
① ; ②Na2CO3; ③ ; ④NaHCO3
将得到的固体重新溶解于水,在溶液中加一定量硫酸,使溶液中只含一种溶质,再将溶液蒸干,得到固体的物质的量是 摩。
查看答案和解析>>
科目: 来源: 题型:
I.右图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
①Vml该浓盐酸中Cl_的物质的量为
②取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 。
A.溶液中HCl的物质的量 B.溶液中Cl-的数目
C.H+的物质的量浓度 D.溶液的密度
II、现有失去标签的四瓶无色溶液A、B、C、D,只知道它们是K2CO3、K2SO4、K HSO4和Ba(NO3)2,为了鉴别它们,进行如下实验:
①.A+D![]() 溶液+气体 ②.B+C
溶液+气体 ②.B+C![]() 溶液+沉淀
溶液+沉淀
③.B+D![]() 溶液+沉淀 ④.A+B
溶液+沉淀 ④.A+B![]() 溶液+沉淀
溶液+沉淀
⑤.将④得到的沉淀物加入③所得溶液中,④中沉淀很快溶解并产生无色无味的气味。
根据以上实验事实,B、D分别为______、_____(用化学式表示).

查看答案和解析>>
科目: 来源: 题型:
部分氧化的Fe-Cu合金样品(氧化物为Fe2O3、CuO)共5.76g,经如下处理:

下列说法正确的是( )
A.滤液A中的阳离子为Fe2+、Fe3+、H+ B.样品中CuO的质量为4.0 g
C.样品中Fe元素的质量为2.24 g D.V=896
查看答案和解析>>
科目: 来源: 题型:
氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO来合成。下列叙述正确的是( )
2AlN+3CO来合成。下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1molAlN需转移电子数为3NA
C.AlN中氮元素的化合价为+3 D.铝元素被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com