
科目: 来源: 题型:
已知如下物质的溶度积常数FeS:Ksp=6.3×10-18;CuS:Ksp=1.3×10-36;ZnS:Ksp=1.6×10-24.下列说法正确的是
A.同温度下,CuS的溶解度大于ZnS的溶解度
B.将足量CuSO4溶解在0.1 mol·L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35 mol·L-1
C.因为H2SO4是强酸,所以Cu2++H2S===CuS↓+2H+不能发生
D.除去工业废水中的Cu2+,可以选用FeS做沉淀剂
查看答案和解析>>
科目: 来源: 题型:
向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为
A.减小、增大、减小 B.增大、减小、减小
C.减小、增大、增大 D.增大、减小、增大
查看答案和解析>>
科目: 来源: 题型:
下图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是
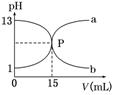
A.盐酸的物质的量浓度为1 mol/L
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用作本实验的指示剂
查看答案和解析>>
科目: 来源: 题型:
室温下,甲溶液中水电离出的H+浓度为10-12 mol·L-1,乙溶液中水电离出的H+浓度为10-2 mol·L-1,下列说法中正确的是
A.甲、乙两溶液的pH不可能相同
B.甲、乙两种溶液中加入Al粉都会产生H2
C.HCO![]() 不可能在甲、乙两溶液中大量共存
不可能在甲、乙两溶液中大量共存
D.甲不可能是盐溶液,乙不可能是酸或碱溶液
查看答案和解析>>
科目: 来源: 题型:
将pH=3的盐酸a L分别与下列三种溶液混合后,混合液均呈中性:
①1×10-3 mol·L-1的氨水b L
②c(OH-)=1×10-3 mol·L-1的氨水c L
③c(OH-)=1×10-3 mol·L-1的Ba(OH)2溶液d L
其中a、b、c、d的关系正确的是
A.b>a=d>c B.a=b>c>d
C.a=b>d>c D.c>a=d>b
查看答案和解析>>
科目: 来源: 题型:
在醋酸溶液中,CH3COOH电离达到平衡的标志是
A.溶液显电中性
B.溶液中检测不出CH3COOH分子存在
C.氢离子浓度恒定不变
D.c(H+)=c(CH3COO-)
查看答案和解析>>
科目: 来源: 题型:
把铝、铁混合物1.1 g溶于200 mL 5mol/L盐酸中,反应后盐酸的浓度变为
4.6mol/L(溶液体积变化忽略不计).
求:
(1)反应中消耗HCl的物质的量.
(2)该混合物中铝、铁的物质的量.
查看答案和解析>>
科目: 来源: 题型:
Ⅰ 溴被称为海洋元素,向盐卤中通入氯气可制得溴:Cl2 + 2NaBr = 2NaCl + Br2,该反应被氧化的元素为 (写元素符号);若上述反应制得16g Br2 ,则转移的电子数目是 个。
Ⅱ 请按要求书写化学方程式或离子方程式
(1)小明运用化学实验证明了久置于空气中的漂白粉已变质,请用化学方程式表示漂白粉变质的原因 。
(2)FeSO4溶液用稀H2SO4酸化,放置一段时间后略显黄色,写出变化过程的离子方程式
;
然后向其中滴加KI-淀粉溶液变蓝色,写出变化过程的离子方程式 _。
查看答案和解析>>
科目: 来源: 题型:
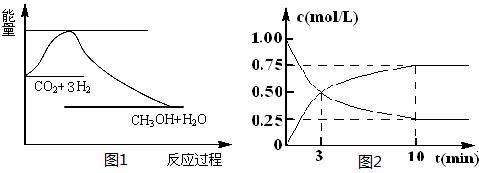
实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下
发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) = ;H2的转化率w(H2) = 。
②该反应的平衡常数表= 。
达式K
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:_____________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入和通入的物质有__________ _;其正极的电极反应式是:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com