
科目: 来源: 题型:
为研究金属腐蚀的条件和速率,某课外小组学生用金属丝将三根大小相同的铁钉分别固定在图示的三个装置中,再放置于玻璃钟罩里保存一星期后,下列对实验结束时现象描述不正确的是( )
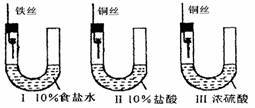
A.装置Ⅰ左侧的液面一定会上升 B.左侧液面装置Ⅰ比装置Ⅱ的低
C..装置Ⅱ中的铁钉腐蚀最严重 D.装置Ⅲ中的铁钉几乎没被腐蚀
查看答案和解析>>
科目: 来源: 题型:
下列关于离子交换膜法电解食盐水的说法错误的是( )
A.阴极产物为NaOH和H2 B.所用离子交换膜只允许阴离子通过
C.阳极反应式为2Cl-―2e-= Cl2↑ D.阳极室注入净制的食盐水
查看答案和解析>>
科目: 来源: 题型:
下列物质在一定条件下能通过缩合聚合反应生成高分子化合物的是( )
A.CH3CH=CH2 B.CH3COOCH2CH3
C.CF2=CF2 D.HOCH2CH2OH和HOOC—COOH
查看答案和解析>>
科目: 来源: 题型:
化学与生产、生活密切相关。下列叙述正确的是( )
A.煤的干馏和石油的分馏均属化学变化
B.明矾可用于水的消毒、杀菌
C.使用无磷洗衣粉,可彻底解决水体富营养化问题
D.醋可用于除去暖水瓶中的水垢
查看答案和解析>>
科目: 来源: 题型:
可逆反应①X(g)+2Y(g)![]() 2Z(g) 、②2M(g)
2Z(g) 、②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示: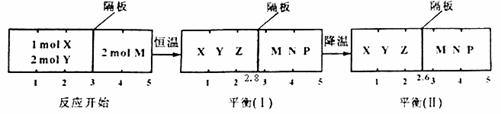
反应①的正反应是 反应(填“放热”或“吸热”);达平衡(I)时体系的压强与反应开始时体系的压强之比为 ;达平衡(I)时,X的转化率为 ;
查看答案和解析>>
科目: 来源: 题型:
研究NO2、SO2 、CO等大气污染气体的处理方法具有重要的意义。
(1)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
若测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
查看答案和解析>>
科目: 来源: 题型:
水的电离平衡曲线如下图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
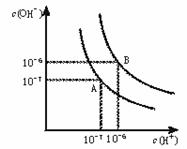 (2)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
(2)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
(3)在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,Ca(OH)2的离子积为 。
(4))25℃时,在等体积的 ① pH=0的H2SO4溶液、②0.05mol/L的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
查看答案和解析>>
科目: 来源: 题型:
甲、乙两池电极材料都是铁棒与碳棒(如图)。请回答下列问题:

(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的________棒;乙池中的________棒。
②在乙池中阳极的电极反应是_______________________________________。
(2)若两池中均盛放饱和NaCl溶液:
①写出乙池中总反应的离子方程式:_____________________________________。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去。这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸。则该反应的化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法 该法的工艺流程为:

其中第①步存在平衡:2CrO42—(黄色)+2H+![]() Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色。
(2)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+ (aq)+3OH—(aq)
Cr3+ (aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法 该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的原因为 。
(5)在阴极附近溶液pH升高的原因是(结合电极反应式解释) ;
溶液中同时生成的沉淀还有
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com