
科目: 来源: 题型:
FeCl3溶液中,加入难溶于水的CaCO3粉末,观察到CaCO3逐渐溶解,产生无色气体和红褐色沉淀。则:
(1)气体为 ,红褐色沉淀为 。
(2)上述现象产生的理由是(用离子方程式及简要文字表 。
在Na2CO3溶液中滴加酚酞显红色。
(3)溶液显红色的原因是(写离子方程式) 。
(4)将溶液加热观察到的现象为 。
(5)在溶液中加足量BaCl2溶液,观察到的现象为 。
查看答案和解析>>
科目: 来源: 题型:
某温度下,在容积固定不变的密闭容器中发生下列可逆反应:X(g) + 2Y(g)![]() 2Z(g)。
2Z(g)。
平衡时,X、Y、Z的物质的量分别为1 mol、1 mol、2 mol,保持温度不变,再向容器中分别充入1 mol、1 mol、2 mol的X、Y、Z,则下列叙述中正确的是
A.刚充入时,反应速率V (正)减小,V (逆)增大
B.达到新平衡时,容器内气体的平均相对分子质量增大
C.达到新平衡时,容器内气体的压强是原来的两倍
D.达到新平衡时,容器内气体的百分组成和原来相同
查看答案和解析>>
科目: 来源: 题型:
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是
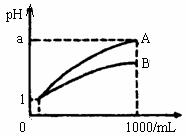
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
查看答案和解析>>
科目: 来源: 题型:
放热反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。其他条件不变升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。其他条件不变升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
A.若增大CO浓度,K2 和K1都增大 B.K2 >K1
C.c2(CO)=c2(H2O) D.c1(CO)>c2(CO)
查看答案和解析>>
科目: 来源: 题型:
分别将下列物质:①CuSO4 ②Na2O2 ③NaCl ④FeCl3 投入水中,对其溶液加热蒸干,仍能得到原物质的是
A.①②③ B.①③ C.③④ D.③
查看答案和解析>>
科目: 来源: 题型:
工业上制备纯硅反应的热化学方程式为:
SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g);△H = +QkJ/mol (Q>0),一定温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g);△H = +QkJ/mol (Q>0),一定温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A、反应过程中,若将硅移出体系,能提高SiCl4的转化率
B、若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C、反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(L![]() min)
min)
D、当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/L的NaOH溶液恰好完全反应
查看答案和解析>>
科目: 来源: 题型:
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(aq) ![]() H+(aq) + In-(aq)
H+(aq) + In-(aq)
红色 黄色
浓度为0.02 mol·L-1的下列各溶液:
①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液
⑤NaHCO3溶液 ⑥氨水,
其中能使指示剂显红色的是
A.①④ B.②⑤⑥ C.①④⑤ D.②③⑥
查看答案和解析>>
科目: 来源: 题型:
关于NaHCO3水溶液的表述正确的是
A.c (Na+)= c (HCO3-) + 2c (CO32-) + c (H2CO3)
B.c (OH-) + 2c (CO32-) + c (HCO3-) = c (H+) +c (Na+)
C.HCO3-的电离程度大于HCO3-的水解程度
D.存在的电离平衡有:
NaHCO3![]() Na++HCO3—,HCO3—
Na++HCO3—,HCO3— ![]() H++CO32—,H2O
H++CO32—,H2O ![]() H++OH—
H++OH—
查看答案和解析>>
科目: 来源: 题型:
铅蓄电池效率低,污染大,目前正逐步被锌电池取代.锌电池的原料为锌、空气和电解质溶液,电池反应为2Zn+O2=2ZnO,下列关于锌电池的叙述中,正确的是
A.锌为负极,空气进入负极发生反应
B.正极发生氧化反应,负极发生还原反应
C.负极电极反应是:Zn – 2e- +2OH-=ZnO+H2O
D.电池工作时,溶液的pH变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com