
科目: 来源: 题型:
氮可形成多种氧化物,如NO、NO2、
 N2O4等,NO2和N2O4可以相互转化。
N2O4等,NO2和N2O4可以相互转化。
(1)对反应2NO2(g) ![]() N2O4(g)
N2O4(g)
△H=-57.2kJ·mol-1
①在温度为T1、 T2时,平衡体系中NO2的体
积分数随压强变化曲线如图所示。T1 T2
(填“大于”、“小于”或“等于”);
②A、C两点气体的平均相对分子质量:A C(填“大于”、“小”或“等于”)
(2)在100℃时,将0.40mol的NO2气体充入2L的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n 4 |
| n(N2O4)/mol | 0.00 | 0.05 | n 2 | 0.08 | 0.08 |
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为 。
②该条件下平衡常数K的值为 。
③若其他条件不变,下列既能加快正反应速率又能提高NO2转化率的措施是 A.抽出N2O4 B.降低温度 C.加压 D.加入催化剂
④若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,
N2O4的起始的物质的量是 。
⑤若其它条件不变,只将容器改为带活塞的恒压容器,
则平衡时N2O4的量 0.08mol。(填“大于”、“小于”或“等于”)
查看答案和解析>>
科目: 来源: 题型:
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。(注:“原子经济性”是指,在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中)
(1)工业上一般采用下列两种反应合成甲醇
反应I: CO(g) + 2H2(g) ![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
上述反应符合“原子经济”原则的是: (填“I”或“Ⅱ”)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ·mol-1
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ·mol-1
③ H2O(g) = H2O(l) ΔH = -44.0 kJ·mol-1
请写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式
______________________________________________________________
 (3)甲醇—空气燃料电池,电解质溶液是:20%~30%的KOH溶液。请写出甲醇—空气燃料电池放电时正极的电极反应式。Ks5u
(3)甲醇—空气燃料电池,电解质溶液是:20%~30%的KOH溶液。请写出甲醇—空气燃料电池放电时正极的电极反应式。Ks5u
。
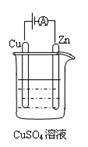
(4)右图是一个电化学过程示意图。
① 锌片上发生的电极反应式为 。
② 假设使用甲醇—空气燃料电池作为本过程中的电源,铜片的质量变化96g,则燃料电池理论上需要 mol甲醇。
查看答案和解析>>
科目: 来源: 题型:
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
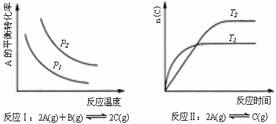
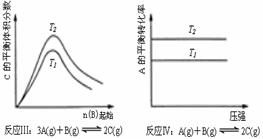
根据以上规律判断,上列结论正确的是
A.反应Ⅰ:△H>0,P2>P1 Ks5u
B.反应Ⅱ:△H<0,T1<T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1
D.反应Ⅳ:△H<0,T2>T1
查看答案和解析>>
科目: 来源: 题型:
图中所示化合物A(fumimycin)是:从微生物中分离得到的,它显示出广谱抗菌活性。下列关于化合物A的说法中,正确的是:
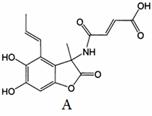
A.该化合物A的分子式为:C15H15O6N
B.化合物A不与NaHCO3反应
C.化合物A与足量的NaOH反应,1mol A可以消耗4mol NaOH
D.化合物A可以水解得到2种有机物
查看答案和解析>>
科目: 来源: 题型:
小红在帮实验员整理化学试剂时,发现一瓶标签破损的无色溶液,标签严重破损,只能隐约看到一部分(如右图)。下列说法不正确的是:

A.该有机物肯定是:甲酸乙酯能发生银镜反应
B.该有机物的分子式为C3H6O2
C.在酸性条件下水解生成两种有机产物的相对分子质量可能相等
D.在碱性条件下可完全水解
查看答案和解析>>
科目: 来源: 题型:
以纯铜作阴极,以石墨作阳极,电解某浓度的硫酸铜溶液,阴极产物均附在电极上,通电一段时间后,关闭电源,迅速撤去电极(设阴极产物没有损耗),若在电解后的溶液中加入4.9g Cu(OH)2 固体,则恰好能使溶液恢复到原浓度,则整个电解过程中,所产生的气体总体积为(标准状况):
A.2.24L B. 1.12L C.0.56L D.3.36L
查看答案和解析>>
科目: 来源: 题型:
物质A分子式为C10H20O2,实验表明A 在热的稀硫酸溶液生成B和C,C在一定条件下连续氧化为B, 由此判断A的可能的结构有:
A.6种 B.4种 C.3种 D.2种
查看答案和解析>>
科目: 来源: 题型:
铁镍蓄电池又称爱迪生电池,放电时的总反应为:
Fe+Ni2O3+3H2O ![]() Fe(OH)2+2Ni(OH)2下列有关该电池的说法不正确的是:
Fe(OH)2+2Ni(OH)2下列有关该电池的说法不正确的是:
A. 电池的电解液为碱性溶液,正极为Ni2O3.负极为Fe
B. 电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
C. 电池充电过程中,阴极附近溶液的pH降低
D. 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
查看答案和解析>>
科目: 来源: 题型:
有关该物质的说法正确的是:
A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B.滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键
C.1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2 和H2分别为4 mol、7 mol
D.该分子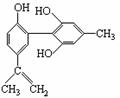 中的所有碳原子不可能共平面
中的所有碳原子不可能共平面
查看答案和解析>>
科目: 来源: 题型:
下列说法或表示方法正确的是:
A.由C(石墨)= C(金刚石) △H = +1.90 kJ∙mol-1 可知金刚石比石墨稳定
B.在稀溶液中,H+(aq)+ OH—(aq)= H2O(l) △H =-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ
C.甲烷的标准燃烧热为△H =-890kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H = -890 kJ∙mol-1
D.已知:H2(g)+F2(g) = 2HF(g);△H= -270 kJ∙mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com