
科目: 来源: 题型:
下列热化学方程式中,△H能正确表示物质的燃烧热的是
A.2CO(g) +O2(g) ==2CO2(g) △H=—566.0 kJ/mol
B.C(s) +1/2O2(g) ==CO(g) △H=—110.5 kJ/mol
C. CH4(g) +2O2(g)== CO2(g)+2H2O(l) △H=—890.31 kJ/mol
D. 2C8H18(l) +25O2(g)==16CO2(g)+18H2O(l) △H=—11036 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
12.8g铜片与50mL某浓度的硝酸恰好完全反应,生成硝酸铜和NO、NO2混合气体,且收集到的混合气体在标准状况下体积为4.48 L; 请计算:
(1)被还原的硝酸的物质的量为__________mol。
(2)求原硝酸的物质的量浓度。
(3)若将收集着气体的集气瓶倒立于足量水中,通入多少升标准状况下的O2,可以使集气瓶中充满溶液?
查看答案和解析>>
科目: 来源: 题型:
为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
【探究一】
(1)常温下,工业上用铁质容器盛放冷的浓硫酸,其原因是 ;
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
① 甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用 ;
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
② 乙同学取560mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O===2HBr +H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为 。
【探究二】
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体在标准状况下密度为0.0893g·L-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。
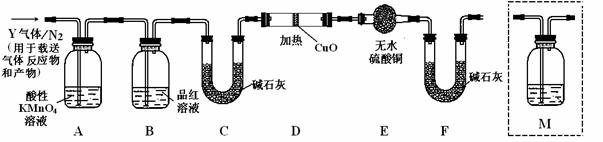
(3)装置B中试剂的作用是 ;
(4)分析Y气体中的Q2气体是如何生成的 (用化学方程式表示);
(5)为确认Q2的存在,需在装置中添加洗气瓶M于 ;
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是 。
查看答案和解析>>
科目: 来源: 题型:
实验室欲配制100mL 0.5mol/L的Na2SO4溶液,试回答: ![]()
(1)实验中用不到的仪器是: ;
A.烧杯 B.圆底烧瓶 C.100mL容量瓶 D.胶头滴管 E.玻璃棒
(2)配制时应称取Na2SO4 g;
(3)在配制一定物质的量浓度溶液的实验中,下列操作会使所配溶液的浓度偏大的是 。
A.在烧杯中溶解溶质,搅拌时不慎溅出少量溶液
B.未将洗涤烧杯内壁的溶液转移入容量瓶
C.将配得的溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出
D.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
E.定容时俯视液面
查看答案和解析>>
科目: 来源: 题型:
右图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体,F是红棕色气体。根据下图关系推断:
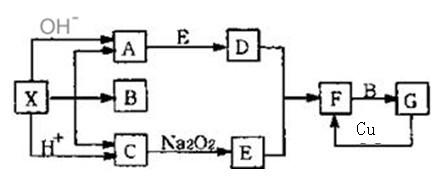
(1)化学式:X ___________。
(2) 写出C—→E的化学反应方程式______________________________________
(3) 请写出F与B反应生成G的化学方程式:____________________,该反应过程中氧化产物和还原产物的物质的量之比为__________________。
查看答案和解析>>
科目: 来源: 题型:
请按要求回答下列问题:
(1)硅在无机非金属材料中一直扮演着重要角色,被誉为无机非金属材料的主角。
①下列物品用到硅单质的是 ;
A.玻璃制品 B.石英钟表 C.计算机芯片 D.光导纤维 E.太阳能电池
② 硅酸盐组成复杂,往往用氧化物的形式表示,某硅酸盐其主要化学成分为Ca2Mg5Si8O22(OH)2. 把它写成氧化物的形式为: ;
(2)Cl2和SO2都具有漂白性,但将这两种气体按体积比1:1通入水中得到的溶液却几乎没有漂白性,写出Cl2和SO2 1:1通入水中发生的离子反应方程式:_______________________________________________________________________;
(3)写出二氧化硫与双氧水反应的化学方程式,并标出电子转移方向和数目: ______________________ ________ ____ 。
查看答案和解析>>
科目: 来源: 题型:
实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应如下:
KMnO4 + HCl(浓) → KCl + MnCl2 + Cl2↑ + H2O
(1) 配平反应方程式:
KMnO4 + HCl(浓) → KCl + MnCl2 + Cl2↑ + H2O
(2)当有0.2mol电子发生转移时,生成氯气的体积(标准状况) L,被氧化的氯化氢的物质的量为 mol。该反应中HCl体现了 性和 性。
查看答案和解析>>
科目: 来源: 题型:
用20mL 18.4mol·L-1 浓H2SO4与金属铜共热一段时间后,冷却,过滤,除去多余的铜,将滤液加水稀释到100mL,所得溶液中SO42-的物质的量浓度为3.18mol·L-1,则此时溶液中CuSO4的物质的量浓度为 ( )
A. 0.50 mol·L-1 B. 0.75 mol·L-1 C. 1.00 mol·L-1 D. 3.18 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
向Fe和Fe2O3的混合物中加入足量的稀硫酸,充分反应后生成FeSO4溶液,当生成的Fe2+和H2的物质的量之比为5︰2时,Fe和Fe2O3的物质的量之比为 ( )
A.3︰1 B.1︰2 C.2︰1 D.1∶1
查看答案和解析>>
科目: 来源: 题型:
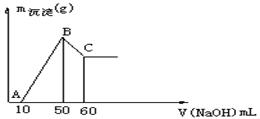
某无色溶液中含有H+、Al3+、Mg2+三种阳离子,逐滴加入0.1moL·L-1 NaOH溶液,消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系如下图所示,则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为 ( )
A. 1:1:1 B. 2:2:1 C. 2:1:1 D. 1:1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com