
科目: 来源: 题型:
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
查看答案和解析>>
科目: 来源: 题型:
关于胶体和溶液的区别,下列叙述中正确的是
A.溶液呈电中性,胶体带有电荷
B.溶液中溶质微粒可透过滤纸,胶体中分散质微粒不可透过滤纸
C.溶液中溶质微粒作有规律的运动,胶体粒子运动无规律
D.溶液中通过一束光,无特殊现象,而胶体中有“光亮的通路”
查看答案和解析>>
科目: 来源: 题型:
用实验确定HCOOH是弱电解质。两同学的方案是:
甲:①称取一定质量的HCOOH配制0.1 mol·L-1的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HCOOH是弱电解质。
乙:①用已知物质的量浓度的HCOOH溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;②分别取这两种溶液各10 mL,加水稀释为100 mL;③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HCOOH是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是 。
(2)甲方案中,说明HCOOH是弱电解质的理由是测得溶液的pH 1(选填>、<、=)。
乙方案中,说明HCOOH是弱电解质的现象是
a.装HCl溶液的试管中放出H2的速率快;
b.装HCOOH溶液的试管中放出H2的速率快;
c.两个试管中产生气体速率一样快:
(3)一定温度下有:a.盐酸;b.硫酸;c.醋酸三种酸。
①当其物质的量浓度相同时,c(H+)由大到小的顺序是___________________________。
②当c(H+)相同、体积相同时,同时加入镁,若产生相同体积的H2(相同状况),则开始时的反应速率____________________。(用a b c的大小关系表示)
查看答案和解析>>
科目: 来源: 题型:
已知如图所示的可逆反应:
A(g)+B(g)![]() 2C(g) +D(g);ΔH = Q kJ/mol
2C(g) +D(g);ΔH = Q kJ/mol
 请回答下列问题:
请回答下列问题:
(1)Q 0(填“>”、“<”或“=”)
(2)在某温度下,反应物的起始浓度分别为:
c(A)= 1.0 mol/L, c(B)=2.0 mol/L ;达到平衡后,
A的转化率为50%,
此时B的转化率为 ;
(3)若反应温度升高,A的转化率
(填“增大”“减小”或“不变”);
(4)若反应温度不变,反应物的起始浓度分别为:c(A)= 3 .0mol/L,
c(B)= a mol/L;达到平衡后,c(D)=1.0 mol/L,a= ;
(5)反应体系中加入催化剂,反应速率增大,则E1的变化是:E1_______,ΔH的变化是:ΔH________(填“增大”“减小”“不变”)。
查看答案和解析>>
科目: 来源: 题型:阅读理解
中和热的测定是高中重要的定量实验。取0.55mol/L的
|
进行中和热的测定实验,回答下列问题:
(1)从右图实验装置看,其中尚缺少的一种玻璃用品是__________,
除此之外,装置中的一个明显错误是 。
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在
于___________。
(3)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1 NaOH溶液进
行反应与上述实验相比,所放出的热量 (填“相等”“不相等”),若实验操作均正确,则所求中和热 填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:________。 (从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)使硫酸与NaOH溶液混合均匀的正确操作是:________。 (从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(6)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 |
|
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=__________ ( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
查看答案和解析>>
科目: 来源: 题型:
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。
(1)在250C、101KPa时,3.2克甲醇(CH30H)完全燃烧生成CO2和液态水时放热72.576kJ,
 则能表示甲醇燃烧的热化学方程式为___________________。
则能表示甲醇燃烧的热化学方程式为___________________。
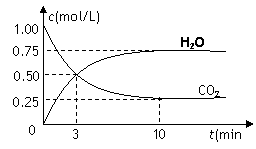
(2)为探究反应原理,现进行如下实验,在体积
为2 L的密闭容器中,充入2mol CO2和6mol H2,一
定条件下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=—49kJ/mol
CH3OH(g)+H2O(g) △H=—49kJ/mol
测得CO2和H2O (g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=__________mol/(L·min)。
②下列措施中能使n(H2O)/n(CO2)增大的是________。
A.升高温度 B.再充入3mol H2
C.将CH3OH (g)从体系中分离 D.充入He(g),使体系压强增大
查看答案和解析>>
科目: 来源: 题型:
高温下,某反应达平衡,平衡常数![]() 。恒容时,温度升高,B的浓度减小。下列说法正确的是
。恒容时,温度升高,B的浓度减小。下列说法正确的是
①该反应的焓变为正值 ②恒温恒容下,增大压强,B浓度一定减小
③升高温度,逆反应速率减小 ④该反应化学方程式为C(g) +D(g) ![]() A(g)+B(g)
A(g)+B(g)
⑤增加A的量,平衡向正反应方向移动 ⑥加入催化剂,B的转化率提高
A. ①③⑥ B. ①⑤ C. ①④⑤ D. ②⑤
查看答案和解析>>
科目: 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g) ![]() Si(s)+4HCl(g);ΔH= +Q kJ·mol-1mol(Q>0)
Si(s)+4HCl(g);ΔH= +Q kJ·mol-1mol(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C. 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
D. 反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
查看答案和解析>>
科目: 来源: 题型:
250 ℃和1.01×105 Pa时,反应2XY3(g) ===X2(g)+3Y2(g) ΔH=+56.76 kJ/mol,自发进行的原因是
A.熵增大效应大于能量效应 B.是放热反应
C.是熵减少的反应 D.是吸热反应
查看答案和解析>>
科目: 来源: 题型:
大气污染问题已成影响环境的重要因素,有人想利用2CO(g)+SO2(g) ![]() 2 CO2 (g) +S (g) ΔH= +8.0 kJ·mol-1的反应来减少污染,使用新型催化剂加快反应。下列有关该反应过程的能量变化示意图正确的是
2 CO2 (g) +S (g) ΔH= +8.0 kJ·mol-1的反应来减少污染,使用新型催化剂加快反应。下列有关该反应过程的能量变化示意图正确的是
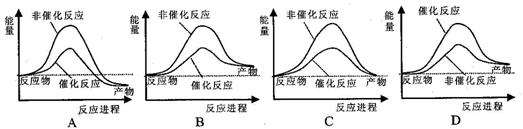
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com