
科目: 来源: 题型:
浓硫酸在下列转化中,既表现出氧化性又表现出酸性的是 ( )
A.Cu―→CuSO4 B.C―→CO2
C.Fe(OH)3―→Fe2(SO4)3 D.Fe2O3―→Fe2(SO4)3
查看答案和解析>>
科目: 来源: 题型:
设NA代表阿伏加德罗常数,下列说法正确的是( )
A.24g金属镁变为镁离子时失去的电子数为NA
B.18g水所含的电子数目为NA
C.标准状况下,11.2L SO3所含的分子数目为0.5NA
D.在常温常压下32g氧气所含的原子数目为2NA
查看答案和解析>>
科目: 来源: 题型:
高锟因在光学通信领域,光在光纤中传输方面所取得的开创性成就而获得2009年诺贝尔物理学奖。光纤通讯是光作为信息的载体,让光在光导纤维中传输。制造光导纤维的基本原料是( )
A.铜 B.铁 C.石英 D.纯碱
查看答案和解析>>
科目: 来源: 题型:
恒温、恒压下,在一个可变容积的容器中发生如下发应:
A(g)+B(g) ![]() C(g)
C(g)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为___________mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,
则x= mol,y= mol。平衡时,B的物质的量 (选填一个编号)
甲.大于2mol 乙.等于2mol 丙.小于2mol 丁.可能大于、等于或小于2mol
作出此判断的理由是 。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。
查看答案和解析>>
科目: 来源: 题型:
(1)二氧化硫的催化氧化的过程如图所示,其中a、c二步的化学方程式可表示为:
 SO2+V2O5
SO2+V2O5![]() SO3+ V2O4
SO3+ V2O4
4VOSO4+O2![]() 2V2O5+4SO3。
2V2O5+4SO3。
 该反应的催化剂是 (写化学式)
该反应的催化剂是 (写化学式)
(2)550 ℃时,SO2转化为SO3的平衡转化率(α)与
体系总压强(p)的关系如右图所示。将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。试计算反应2SO3![]() 2SO2+O2 在550 ℃时的平衡常数K= 。
2SO2+O2 在550 ℃时的平衡常数K= 。
(3)550 ℃时,将2.0 mol SO2和1.0 mol O2置于5L密闭容器中,反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高温度 B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2 D.再充入1 mol SO2和1 mol O2
(4)维持温度不变条件下使之发生如下反应:2SO2+O2![]() 2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。
2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。
试填写下列空格:ks5u
 A容器达到平衡时所需的时间比B容器__ _(填:“短”
A容器达到平衡时所需的时间比B容器__ _(填:“短”
或“长”);平衡时A容器中SO2的转化率比B容器_______(填:
“大”或“小”);达到所述平衡后,若向两容器中通入等物质的量的
原反应气体,达到平衡时,A容器的混合气体中SO3的体积分
数_________(填“增大”、“减小”或“不变”,下同);B容器的
混合气体中SO3的体积分数_________。
查看答案和解析>>
科目: 来源: 题型:
50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
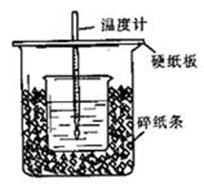
(1)从实验装置上看,图中尚缺少的一种玻璃用品是___________________________。
(2)25℃,101kPa时,1mol稀硫酸与氢氧化钠稀溶液完全反应生成液态水放出114.6kJ的热量,表示该反应中和热的热化学方程式为________________________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________________(填“偏大”、“偏小”、“无影响”)。
(4)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”、“不相等”),所求中和热_________(填“相等”、“不相等”),简述理由___________________ __________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会___________________________;用50 mL 0.50 mol/L NaOH溶液进行上述实验,测得的中和热的数值会____________ ______。(均填“偏大”、“偏小”、“无影响”)
查看答案和解析>>
科目: 来源: 题型:
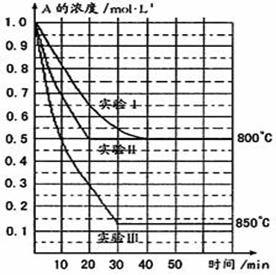
在一恒容密闭容器中发生某化学反应2A(g) ![]() B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示:
B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示:
试回答下列问题:
(1)在实验Ⅰ中,反应在20 min至40 min内A的平均反应速率为____ ______。
(2)实验Ⅱ和实验I相比,可能隐含的反应条件是_______________ ______________。
(3)根据实验Ⅲ和实验Ⅰ的比较,可推测该反应降低温度,平衡向_____(填“正”或“逆”)反应方向移动,该正反应是_________(填“放热”或“吸热”)反应。
(4)与实验Ⅰ相比,若实验Ⅰ中的A的起始浓度改为0.8 mol·L-1,其它条件不变,则达到平衡时所需用的时间___________实验Ⅰ(填写“大于”、“等于”或“小于”)。
查看答案和解析>>
科目: 来源: 题型:
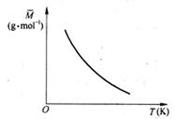
已知反应2A(g) ![]() B(?)+ 2C(?) △H>0,满足如图所示的关系,则下列说法中正确的是
B(?)+ 2C(?) △H>0,满足如图所示的关系,则下列说法中正确的是
A.B、C可能均为非气态
B.若B是气态,则C一定也只能是气态
C.若B为固态,则C一定为气态
D.B、C可能均是气态
查看答案和解析>>
科目: 来源: 题型:
在高温下,反应2HBr(g)![]() H2(g)+Br2(g) △H>0, 达到平衡,要使混合气体颜色加深,可采取的方法是
H2(g)+Br2(g) △H>0, 达到平衡,要使混合气体颜色加深,可采取的方法是
A.减小压强 B.缩小体积 C.升高温度 D.增大氢气浓度
查看答案和解析>>
科目: 来源: 题型:
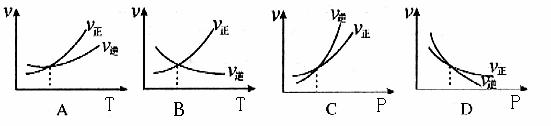
下列各图是温度T(或压强P)对f反应2A(s) + 2B(g) ![]() 2C(g) + D(g) △H>0的正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是
2C(g) + D(g) △H>0的正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com