
科目: 来源: 题型:
可用右图装置制取(必要时可加热)和收集的气体是
A.氯酸钾溶液与二氧化锰反应制氧气
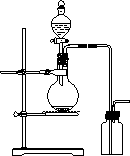 B.浓氨水与氢氧化钙固体制氨气
B.浓氨水与氢氧化钙固体制氨气
C.乙醇和浓硫酸(170℃)制乙烯
D.铜和浓硝酸制二氧化氮
查看答案和解析>>
科目: 来源: 题型:阅读理解
(16分)火柴头上通常含有氯酸钾、二氧化锰、硫等物质。某研究性学习小组进行火柴头中有关物质的实验探究。
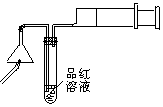 ⑴检验火柴头中含有硫
⑴检验火柴头中含有硫
将两根火柴放在如右图所示实验装置中漏斗下面,用一根燃着的火柴点燃它,慢慢拉动注射器活塞抽气,让火柴燃烧产生的气体通过稀品红溶液,观察到品红溶液褪色。
① 燃烧产生的气体中一定含有 ;
② 可用于替代试管中品红溶液的试剂有 (填标号);
 A.稀高锰酸钾酸性溶液 B.饱和石灰水 C.稀溴水 D.烧碱溶液
A.稀高锰酸钾酸性溶液 B.饱和石灰水 C.稀溴水 D.烧碱溶液
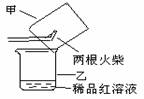
③ 某同学提出用下图所示方法进行实验更为简便。他的操作是:
ⅰ.当图中所示火柴头燃烧完时,立即移出火柴;
ⅱ. 。
⑵测定火柴头中KClO3的含量
主要实验步骤如下:
ⅰ 刮取火柴头,小心研碎,称得质量为2.45g;
ⅱ 用适量蒸馏水充分浸泡后过滤、洗涤残渣;
ⅲ 往装有滤液和洗涤液的烧杯中加入过量的NaNO2溶液、AgNO3溶液和稀硝酸,搅拌,充分反应后,过滤、洗涤沉淀;
ⅳ 干燥沉淀物,称得其质量为1.435g。
① 实验中发生的反应是 KClO3 + 3NaNO2 + AgNO3 = AgCl↓+ 3NaNO3 + KNO3,其中NaNO2是 剂,反应中AgNO3、NaNO2均需要过量的原因是
② 实验测得火柴头中KClO3的质量分数为 ;
③ 如果第ⅱ步中未洗涤沉淀残渣,测得KClO3的质量分数将 (填“偏大”、“偏小”、或“无影响”,下同);如果第ⅲ步中未洗涤AgCl沉淀,测得KClO3的质量分数将 。
查看答案和解析>>
科目: 来源: 题型:
下列实验装置设计正确,且能达到目的的是

测定乙醇结构式 滴定法测定硫酸 合成氨并检验氨的生成 碘的CCl4溶液中分离I2
的物质的量浓度 并回收CCl4
A B C D
查看答案和解析>>
科目: 来源: 题型:
(15分)味精是烹制菜肴时常用的调味品,其主要成分是谷氨酸钠(化学式为C5H8NO4Na)。谷氨酸钠有鲜味,易溶于水。某品牌味精包装上标注:“谷氨酸钠含量≥80%,NaCl含量≤20%”。某学校化学科研小组现对此味精中NaCl的含量进行测定。
Ⅰ.查阅资料:资料表明:谷氨酸钠的存在不影响NaCl含量进行测定。
Ⅱ.设计实验方案:
(1)实验试剂:水、试剂X的溶液等
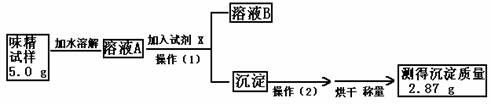 (2)实验过程:
(2)实验过程:
根据上述实验步骤回答下列有关问题:
①试剂X是 其作用是
②操作(1)所需要的玻璃仪器有
③操作(2)的名称是
④通过计算判断该味精中NaCl的质量分数,是否符合其包装上标注的标准。
⑤如果溶液A为50 mL,则溶液A中NaCl的物质的量浓度是多少?
查看答案和解析>>
科目: 来源: 题型:
(10分)味精的主要成分是谷氨酸钠(化学式为C5H8NO4Na),谷氨酸钠有鲜味,易溶于水。某品牌味精包装上标注:“谷氨酸钠含量≥80%,NaCl含量<20%”。 某学校化学兴趣小组对此味精中NaCl的含量设计实验方案进行测定,他们查阅资料得知谷氨酸钠的存在不影响NaCl含量的测定。
他们设计的实验方案如下:
【实验试剂】水、溶液B、稀硝酸等。
【实验过程】
 |
请回答下列问题:
(1)该实验的原理是通过测定 ,计算样品中氯化钠的质量分数。
(2)溶液B是 ,操作Ⅰ的名称是 。
(3)对沉淀进行洗涤的目的是 ;若不进行洗涤操作,则测量结果____________ (填“偏大”、“偏小”或“无影响”)
(4)通过计算判断该味精中NaCl的质量分数 (填“符合”或“不符合”)其包装上的标注。
(5)若溶液A的体积为250 mL,则溶液A中NaCl的物质的量浓度为_________ 。配制一定物质的量浓度的氯化钠溶液时,所需要的玻璃仪器除量筒、玻璃棒、胶头滴管、烧杯外还有 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
(10分)已知常温下甲醛是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一。我国规定:居室中甲醛含量不得超过0.08 mg/m![]() 。可利用酸性高锰酸钾溶液测定甲醛含量。
。可利用酸性高锰酸钾溶液测定甲醛含量。
测定原理:KMnO4 (H![]() )溶液为强氧化剂,可氧化甲醛和草酸。
)溶液为强氧化剂,可氧化甲醛和草酸。
![]() 有关离子方程式为: 4MnO4—+5HCHO+12H+ 4Mn2++5CO2↑+11H2O
有关离子方程式为: 4MnO4—+5HCHO+12H+ 4Mn2++5CO2↑+11H2O
![]() 2MnO4—+5H2C2O4+6H+ 2Mn2++10CO2↑+8H2O
2MnO4—+5H2C2O4+6H+ 2Mn2++10CO2↑+8H2O
 |
测定装置:部分装置如右图所示(a、b为止水夹)。
测定步骤:
①收集待检新装修的房屋居室空气5 L。
②准确量取5.00 mL 1.00×10![]() mol/L的高锰酸
mol/L的高锰酸
钾溶液于250 mL锥形瓶中,滴入3滴6 mol/L
的H![]() SO
SO![]() 溶液,加水45 mL稀释,备用。
溶液,加水45 mL稀释,备用。
③将1.00×10![]() mol/L的草酸标准溶液置于酸式滴定管中备用。
mol/L的草酸标准溶液置于酸式滴定管中备用。
④打开a,关闭b,用注射器抽取100 mL新装修的房屋的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再如此重复4次。
⑤用标准草酸溶液滴定锥形瓶中的溶液,记录滴定所消耗的草酸溶液的体积。
⑥再重复实验2次(每次所取的高锰酸钾溶液均为5.00 mL)。3次实验所消耗草酸溶液的体积平均值为12.38 mL。
回答以下问题:
(1)使用_________量取5.00 mL高锰酸钾溶液。
(2)如果注射器压送气体速度过快,可能会产生什么不良后果?使结果偏高还是偏低? 。
(3)本实验是否需要外加指示剂?若需要请指出指示剂的名称,若不需要,试说明如何确定滴定的终点。
。
(4)计算该居室内空气中甲醛的浓度_________mg/m![]() ,该居室的甲醛________(填“是”或“否”)超标。
,该居室的甲醛________(填“是”或“否”)超标。
查看答案和解析>>
科目: 来源: 题型:
(12分)为测定粗氧化铜(其中含少量氧化亚铁及不溶于酸的杂质)样品中CuO的质量分数,并制取胆矾晶体及测定胆矾晶体中晶体水的含量,某化学活动小组进行了下述实验:
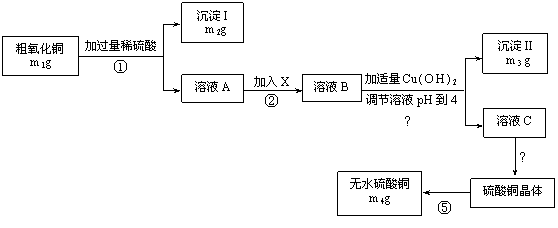 |
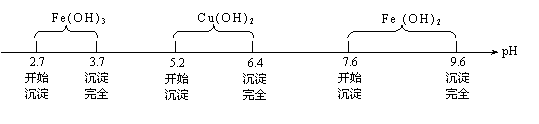 已知Fe3+、Cu2+、Fe2+ 三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:
已知Fe3+、Cu2+、Fe2+ 三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:
请回答下列问题:
(1)调节溶液pH能否选用NaOH溶液,说明理由
(2)沉淀II为 步骤④所用实验操作为
(3)加入物质X目的是
(4)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:若测定结果x值偏大,可能的原因是 ( )
a 加热温度过高 b 加热胆矾晶体时有晶体从坩埚中溅出
c 加热后放在空气中冷却
(5)样品中CuO的质量分数为 (用含m的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
(10分)工业
上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾( FeSO4·7H2O )。
(1)若用98% 1.84 g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1: ▲ 。
(2)为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00 g铁粉充分反应,收集到224 mL(标准状况)气体,剩余固体质量为3.88 g,测得反应后的溶液中Fe2+的物质的量为0.14 mol(不含Fe3+)。则该样品中Fe2+离子的氧化率为 ▲ 。
(3)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.4 g Cu2S和CuS的混合物在酸性溶液中用40 mL 0.150 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V mL 0.2 mol/L (NH4)2Fe(SO4)2溶液完全反应。已知:MnO4-+Fe2++H+——Mn2++Fe3++H2O(未配平)
①V的取值范围为 ▲ ;
②若V=35,试计算混合物中CuS的质量分数。
▲
查看答案和解析>>
科目: 来源: 题型:
题目
下列实验装
置设计正确,且能达到目的的是
 测定乙醇结构式 滴定法测定硫酸 合成氨并检验氨的生成 碘的CCl4溶液中分离I2
测定乙醇结构式 滴定法测定硫酸 合成氨并检验氨的生成 碘的CCl4溶液中分离I2
的物质的量浓度 并回收CCl4
A B C D
查看答案和解析>>
科目: 来源: 题型:
(12分)课外化学兴趣小组欲测定铜锌合金粉末中锌的质量分数。
Ⅰ.除托盘天平必用外,供选择的实验装置如下:
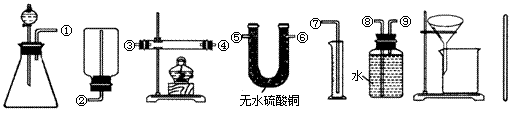 |
A B C D E F G H
Ⅱ.实验中可测得的数据及其代号如下:
样品的质量m1;充分反应生成的气体体积V(标准状况);反应前仪器和药品的总质量m2;充分反应后仪器和药品的总质量m3;充分反应后剩余固体的质量m4。
(1)实验时必须用到的化学试剂为 。
(2)甲同学实验中使用了A、E、F三种装置,组装时接口编号的连接顺序为: 。样品中锌的质量分数的计算式为 。
(3)乙同学实验中测得的数据为m1和m4,他使用的实验装置有 (填字母)。
(4)丙同学实验中只选用了A装置,他要测得的数据有 (填代号)。
(5)丁同学设计了另一种测定方法,他考虑使用A、C、D三种装置,在C装置中添加足量CuO。除测定m1外,还准备测定C装置反应前后的质量变化。请评价该方法是否可行并说明理由: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com