
科目: 来源: 题型:
(10分)氯化铁是常见的水处理剂w ww.ks 5u.co m,无水FeCl3的熔点为555 K、沸点为588 K。工业上制备无水FeCl3的一种工艺如下:
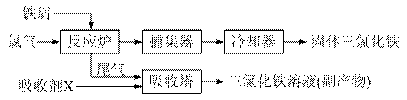
⑴取0.5 mL三氯化铁溶液滴入50 mL沸水中,再煮沸片得红褐色氢氧化铁胶体,其离子方程式可表示为: ▲ ,胶体粒子的直径一般不超过 ▲ 。
⑵吸收塔中吸收剂X是 ▲ 。
⑶温度超过673 K,捕集器中的物质相对分子质量为325,该物质的分子式为 ▲ 。
⑷通常用碘量法测定FeCl3的质量分数:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100 mL容量瓶,用蒸馏水定容;取出10.00 mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用c mol/L Na2S2O3溶液滴定(I2+2S2O32-=2I- +S4O62-),共用去V mL。则样品中氯化铁的质量分数为: ▲ 。
查看答案和解析>>
科目: 来源: 题型:
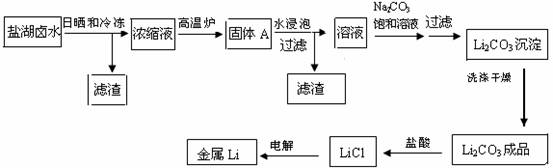
(共8分)锂在原子能工业中具有十分独特的地位,被誉为“高能金属”,它推动着能源工业,尤其是电池技术的发展。盐湖卤水中锂的含量较高,资源丰富,提炼锂的价格低廉,成为国内外开发生产锂的主攻方向。把盐湖卤水自然日晒和冷冻,从卤水中析出食盐、泻利盐、钾盐镁矾和光卤石等一系列盐类,得到富含MgC12的浓缩母液,其中LiC1的浓度达10%以上。把浓缩母液经高温炉分解除去MgC12等一系列过程,最终得到金属锂。其主要生产工艺流程如下:
 已知:Li2CO3在不同温度的溶解度如下表:
已知:Li2CO3在不同温度的溶解度如下表:
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)写出浓缩母液在高温炉中分解的化学方程式
(2)写出盐酸与Li2CO3反应的离子方程式
(3)洗涤所得Li2CO3沉淀要用热水而非冷水,原因是 。
(4)熔融LiCl电解的环境是
a.氢气中b.氮气中c.空气中d.真空中e.He气
查看答案和解析>>
科目: 来源: 题型:
(10分)新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。工艺流程如下图所示。
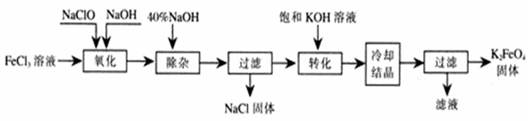
写出“氧化”过程中反应的离子方程式: 。
⑵写出“转化”过程中发生反应的化学方程式为 。
⑶上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是:将粗产品用 溶解,然后 。
方法Ⅱ:电解法。以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH。
⑷电解时阳极发生反应生成FeO42-,该电极反应方程式为 。
查看答案和解析>>
科目: 来源: 题型:
下列有关化学实验不能达到目的的是
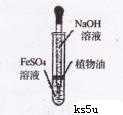 A.采用如图所示的装置制取少量的氢氧化亚铁
A.采用如图所示的装置制取少量的氢氧化亚铁
B.加热苯、液溴和浓硫酸的混合物制取少量的溴苯
C.用素瓷片作催化剂进行石蜡油的受热分解实验
D.用滴有少量硫酸铜溶液的稀硫酸跟锌粒反应快速地制氢气
查看答案和解析>>
科目: 来源: 题型:
B.对氨基
苯磺酸是制取某些染料和药物的重要中间体,可由苯胺磺化得到:
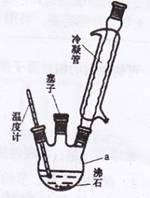
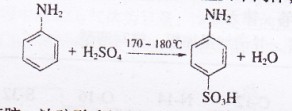
实验室可用苯胺、浓硫酸为原料,利用右图所示实验装置合成。
实验步骤如下:
①取一个250mL的仪器a,加入10mL苯胺及几粒沸石,
放人冷水中冷却,小心地加入18 mL浓硫酸。再分别
装上冷凝管、温度计等。
②将a置于油浴中缓慢加热至170`180℃,维持此温度约2.5 h。
③将反应产物冷却至约50℃后,倒入盛有100 ![]() ,冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出。用该烧杯中的少量冷水将a内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到粗产品。
,冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出。用该烧杯中的少量冷水将a内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到粗产品。
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集
产品,晾干。(提示:100mL水在20℃时可溶解对氨基苯磺酸1.08 g,在100℃时可
溶解6.67 g)
(1)仪器a的名称是 。步骤①中加入沸石的作用是 。
(2)步骤②中采用油浴加热,下列说法正确的是 。(填字母)
A.便于控制温度 B.也可以改用水浴加热 C.温度计的水银球也可浸在油中
(3)步骤③用冷水洗涤的优点是 。
(4)步骤③和④均进行了抽滤操作,在抽滤完毕停止抽滤时,应注意先一二,然
后 。
(5)步骤④有时需重复进行多次,其目的是 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
(12分)对氨基苯磺酸是
制取染料和一些药物的重要中间体,可由苯胺磺化得到。


实验室可利用右图实验装置合成对氨基苯磺酸。实验步骤如下:
在一个250 mL三颈烧瓶中加入10 mL苯胺及几粒沸石,
将三颈烧瓶放入冷水中冷却,小心地加入18 mL浓硫酸。
将三颈烧瓶置于油浴中缓慢加热至170~180℃,维持此温度2~2.5 h。
③ 将反应液冷却至约50℃后,倒入盛有100 mL冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出,抽滤,用少量冷水洗涤,得到的晶体是对氨基苯磺酸粗产品。
④ 将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集产品,晾干。(说明:100 mL水在20℃时可溶解对氨基苯磺酸1.08 g,在100℃时可溶解6.67 g。)
试回答填空。
(1)装置中冷凝管的作用是 ▲ 。
(2)步骤②中采用油浴加热,下列说法正确的是 ▲ (填序号)。
A.用油浴加热的好处是反应物受热均匀,便于控制温度
B.此处也可以改用水浴加热
C.实验装置中的温度计可以改变位置,也可使其水银球浸入在油中
(3)步骤③用少量冷水洗涤晶体的好处是 ▲ 。
(4)步骤③和④均进行抽滤操作,在抽滤完毕停止抽滤时,应注意先 ▲ ,
然后 ▲ ,以防倒吸。
(5)步骤④中有时需要将“粗产品用沸水溶解,冷却结晶,抽滤”的操作进行多次,其目的是 ▲ 。每次抽滤后均应将母液收集起来,进行适当处理,其目的是 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
(14分)某化学研究性学习小组通过查阅资料,设计了如下图所示的方法来制备KMnO4。
 已知:①3MnO2+KClO3+6KOH
已知:①3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
②几种物质的溶解度:
| 温度 | 溶解度/g | ||
| K2CO3 | KOH | KMnO4 | |
| 20℃ | 111 | 112 | 6.38 |
| 60℃ | 127 | 154 | 22.1 |
请回答下列问题:
⑴第一步固体熔融时除三脚架、泥三角、细铁棒、坩埚钳外,还需下列仪器中的 ▲ 。
A.蒸发皿 B.烧杯 C.酒精灯 D.铁坩埚
 ⑵反应Ⅰ中氧化产物与还原产物的物质的量之比为 ▲ ;该反应中可以循环利用的产物是 ▲ 。
⑵反应Ⅰ中氧化产物与还原产物的物质的量之比为 ▲ ;该反应中可以循环利用的产物是 ▲ 。
⑶反应Ⅱ的条件为电解,写出反应Ⅱ的化学方程式 ▲ 。
⑷途径一、二中的操作a、b相同,均包括 ▲ 、过滤等3步。
⑸通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数)。
①实验时要将草酸晶体(H2C2O4·2H2O)配成标准溶液,则配制100mL1.5mol·L—1的草酸溶液,需要称取草酸晶体的质量为 ▲ 。
②该实验中除草酸晶体的质量外,还需要采集的数据有 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
(8分)
以硫酸工艺的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:
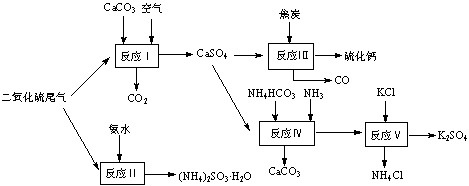
(1)生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是 。
(2)下列有关说法正确的是 。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C![]() CaS +4CO↑
CaS +4CO↑
C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
(3)反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是 。
(4)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫酸铵反应的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
某学习小组拟利用如下装置制备氮化钙(化学式:Ca3N2 ,极易与H2O反应)

下列说法正确的是
A.打开活塞K通入N2,试管A内有气泡产生,说明装置气密性良好
B.U形管中盛放的干燥剂既可以用碱石灰,也可以用浓硫酸
C.反应结束后,先熄灭酒精灯,待反应管冷却后再关闭活塞K
D.将产物Ca3N2放入盐酸中,只能得到一种盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com