
科目: 来源: 题型:
用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH是
A. 4 B. 7.2 C. 10 D. 11.3
查看答案和解析>>
科目: 来源: 题型:
室温下,某溶液中由水电离的c(OH-)为1.0×10-12 mol·L-1,下列离子在该溶液中一定能大量共存的是Ks5u
A.NH4+、Na+ 、SO42- 、Cl- B.Ba2+、 K+ 、ClO-、NO3-
C.Ba2+、 K+ 、Cl-、NO3- D.Na+ 、Ca2+ 、Cl- 、AlO2-
查看答案和解析>>
科目: 来源: 题型:
下列说法中,不正确的是
A.室温下,CH3COOH分子可以存在于pH=8的碱性溶液中
B.在0.1mol•L-1的盐酸中加入适量的蒸馏水,溶液的c(H+)减小
C.在由水电离出的c(OH-)=1×10-12mol•L-1的溶液中,Al3+不可能大量存在
D.在NaAlO2溶液中,Al3+可能大量存在
查看答案和解析>>
科目: 来源: 题型:
t℃时,水的离子积为 Kw,该温度下将a mol·L-1,一元酸HA与 b mol·L-1一元碱 BOH等体积混合,要使混合液呈中性,必要的条件是
A.混合液中,c(H+)= B.混合液的pH=7
C.a=b D.混合液中,c(B+)=c(A-)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
在25 ℃时,将pH = 11的NaOH溶液与pH = 3的CH3COOH溶液等体积混合后,下列关系式中正确的是
A. c(Na+) = c(CH3COO-)
B. c(H+) = c(CH3COO-)+c(OH-)
C. c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D. c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
![]() (9分)我们知道空气中含有N2、O2、CO2、H2S等气体, 分析下列现象的原因。
(9分)我们知道空气中含有N2、O2、CO2、H2S等气体, 分析下列现象的原因。
(1)以酚酞为指示剂,用碱液滴定酸液到显现浅红色在半分钟内不褪色为终点。约半分钟后导致褪色的原因:_____ ________________________。
(2)以淀粉为指示剂,用Na2S2O3滴定I2(2S2O32-+I2===S4O62-+2I-),到蓝色恰好褪去为终点,约5min后溶液又显色的原因:____ ___________。
(3)以紫色KMnO4为标准溶液滴定还原剂,在消耗完还原剂后,再多加0.5—1滴KMnO4溶液后呈现的浅红色在半分钟内不褪色为终点。约半分钟后浅红色褪色的可能原因:_________ 。
查看答案和解析>>
科目: 来源: 题型:
(10分)为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=![]() 。
。
(1)请计算下列溶液的AG。
a. pH=10的溶液; b. 0.1 mol·L-1 盐酸。
(2)请指出酸性及碱性溶液的AG范围。
查看答案和解析>>
科目: 来源: 题型:
如右图,图Ⅰ表示10 mL量筒中液面的位置,A与B、B与C刻度间相差1 mL,图II表示50mL滴定管中液面的位置,D与E刻度间相差1 mL。如果刻度A和D都是4,则两处液面的读数是:
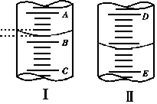 A.Ⅰ中是3.2 mL,Ⅱ中是3.40 mL
A.Ⅰ中是3.2 mL,Ⅱ中是3.40 mL
B.Ⅰ中是4.8 mL,Ⅱ中是3.40 mL
C.Ⅰ中是3.2 mL,Ⅱ中是4.60 mL
D.Ⅰ中是4.8 mL,Ⅱ中是4.60 mL
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.常温下若强酸、强碱等体积中和后pH=7,则中和之前pH酸+pH碱=14
B.为绘制中和滴定曲线,在滴定过程中,每隔相同时间用pH计测定一次锥形瓶中溶液的pH
C.测定溶液的pH时,应先将pH试纸润湿,然后进行检测
D.在pH=12的溶液中,水电离出的c(OH-)=10-2mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com