
科目: 来源: 题型:
在下列给定条件的溶液中,离子一定能大量共存的是
A.pH=1的溶液中:K![]() 、Fe
、Fe![]() 、Cl
、Cl![]() 、NO3-
、NO3-
B.(NH4)2Fe(SO4)2·6H2O溶液中:Na![]() 、Cu
、Cu![]() 、Cl
、Cl![]() 、H
、H![]()
C.![]() =0.1 mol/L的溶液:Na+、NH+4、SO42-、AlO2-
=0.1 mol/L的溶液:Na+、NH+4、SO42-、AlO2-
D.水电离出的c(H+) =10-12mol·L-1的溶液中:Mg2+、NH4+、HCO3-、S2-
查看答案和解析>>
科目: 来源: 题型:
下列有关溶液中各种离子浓度的关系错误的是
A.0.1mol·L-1NH4Cl溶液中:c(Cl-)+ c(OH-) =c(NH4+)+c(H+)
B.0.1mol·L-1NaHSO3溶液中:c(SO32-)+c(HSO3-)+c(H2SO3)=0.1mol·L-1
C.0.1mol·L-1KAl(SO4)2溶液中:c(SO42-)=c(Al3+)+c(K+)
D.足量铁屑溶于稀硝酸所得溶液中:c(NO3-)>c(Fe2+)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
回收的废旧锌锰干电池经过处理后得到锰粉(含MnO2、Mn(OH)2、Fe、NH4Cl和炭黑等),由锰粉制取MnO2的步骤如下图所示:
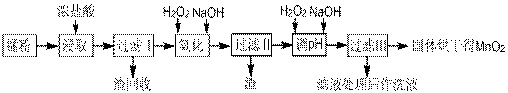

根据上图所示步骤并参考左边表格数据回答问题:
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等。MnO2与浓盐酸反应的离子方程式为 ;这种处理方法不足之处为: 。
(2)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是__________________________。
(3)过滤I的滤渣的化学式为 。过滤Ⅱ的滤渣的化学式为 。
(4)将过滤I所得滤液经H2O2氧化后,再加入NaOH溶液调节pH的范围是: ,其目的是 。
(5)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离于方程式为__________________________________________
查看答案和解析>>
科目: 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
B.标准状况下,22.4L己烷中共价键数目为19NA
C.由SO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32-
查看答案和解析>>
科目: 来源: 题型:
下列操作会使H2O的电离平衡向电离方向移动,且pH<7的是
A.向水中加少量Na2CO3 B.向水中加少量HCl
C.向水中加少量FeCl3 D.将纯水加热到90℃
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是( )
A. pH=3和pH=4的盐酸各10mL混合,所得溶液的pH=3.5
B. 溶液中c(H+)越大,pH值也越大,溶液的酸性就越强
C. 液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质
D. 当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
查看答案和解析>>
科目: 来源: 题型:
对将待测液置于锥形瓶的滴定实验,下列错误操作中,能造成中和滴定结果偏低的是( )
A.未用标准液润洗滴定管?
B.盛标准液的滴定管尖嘴部分有气泡未排除就开始滴定
C.往锥形瓶中加待测液时,锥形瓶中有少许水
D.振荡时锥形瓶中液滴飞溅出来?
查看答案和解析>>
科目: 来源: 题型:
(10分)某温度(t℃)时,水的KW=10-13,则该温度应______25℃(填大于、等于或小于),理由是_______________________________________________,该温度下纯水的pH值为 ,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
(1)若所得混合溶液为中性,则a:b=_________;
(2)若所得混合溶液pH=2,则a:b=__________。
查看答案和解析>>
科目: 来源: 题型:
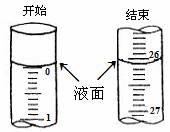
(14分)(1)某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
①用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____ _。直到因加入一滴盐酸后,溶液由红色变为无色,并且__ _ 为止;
②若滴定开始和结束时,酸式滴定管中的液面如图所示:则所滴定盐酸的体积为_________mL;
(2)有一学生在实验室测某溶液的pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净的玻璃棒蘸取试样进行检测。
①该学生的操作是 (正确或错误)。
 ②如不正确,请分析是否一定有误差,为什么? 。
②如不正确,请分析是否一定有误差,为什么? 。
③若用此法分别测定c(H+)相同的盐酸和醋酸的稀溶液的pH,误差较大的是 ___________,原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com