
科目: 来源: 题型:
![]() 加入正催化剂使反应速度加快,下列叙述不正确的是
加入正催化剂使反应速度加快,下列叙述不正确的是
A. 使反应体系的活化分子百分数增高。B. 使反应体系的活化分子总数增多。
C. 使反应体系的活化分子百分数降低。D. 使反应体系的活化能降低。
查看答案和解析>>
科目: 来源: 题型:
判断一个化学反应的自发性常用焓判据和熵判据,则在下列情况下,可以判定反应一定自发进行的是
A.ΔH>0,ΔS>0 B.ΔH<0,ΔS>0
C.ΔH>0,ΔS<0 D.ΔH<0,ΔS<0
查看答案和解析>>
科目: 来源: 题型:
下列说法中正确的是
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,
反应为吸热反应
C.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0
D.ΔH的大小与热化学方程式的计量系数无关
查看答案和解析>>
科目: 来源: 题型:
现用氯水来制取含有次氯酸的溶液,既要提高溶液中HClO物质的量浓度,又要降低溶液中HCl浓度,下列措施可以采用的是( )
A.加热挥发HCl B.加水使平衡向正反应方向移动
C.加NaOH固体 D.加CaCO3固体
查看答案和解析>>
科目: 来源: 题型:
以下反应可以用熵判据来解释的是( )
A.硝酸铵自发地溶于水
B.CaO(s)+CO2(g)==CaCO3(s) △H=-175.7kJ/mol
C.(NH4)2CO3(s)==NH4HCO3(s)+NH3(g) △H=+74.9kJ/mol
D.2H2(g)+O2(g)==2H2O(l) △H=-285.8kJ/mol
查看答案和解析>>
科目: 来源: 题型:
(6分)目前,
聚氯乙烯塑料(PVC)占塑料消费量的30%以上,BICM法用乙烯、氯气等为原料合成PVC,其工艺流程如下。
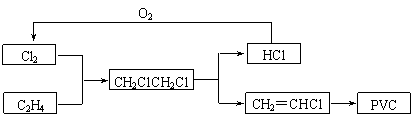
⑴一定条件下,HCl与O2反应可以制取Cl2,其热化学反应方程式为:
4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH < 0。
2Cl2(g)+2H2O(g) ΔH < 0。
降低温度,该反应的化学平衡常数K会 。
A.增大 B.减小 C.不变 D.无法确定
⑵一定温度下某体积可变的容器中充入2LHCl气体和3L空气(氧气占1/5),充分反应后气体体积为4.6L。该反应中HCl气体的转化率为 。
⑶假设BICM法中各步反应的转化率均为100%,计算生产200吨PVC需要购得的氯气质量。
查看答案和解析>>
科目: 来源: 题型:
(10分)
目前,聚氯乙烯塑料(PVC)占塑料消费量的30%以上,BICM法用乙烯、氯气等为原料合成PVC,其工艺流程如下。
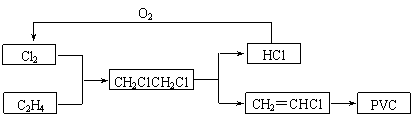
⑴一定条件下,HCl与O2反应制取Cl2的方法称为地康法,其热化学反应方程式为:
4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH=-114.4kJ·mol-1。
2Cl2(g)+2H2O(g) ΔH=-114.4kJ·mol-1。
升高温度,该反应的化学平衡常数K会 ▲ 。
A.增大 B.减小 C.不变 D.无法确定
⑵一定温度下某体积可变的容器中充入4LHCl气体和6L空气(氧气占20%),充分反应后气体体积为9.2L。该反应中HCl气体的转化率为 ▲ 。
⑶假设BICM法中各步反应的转化率均为100%,计算生产1000吨PVC需要购得的氯气质量。
查看答案和解析>>
科目: 来源: 题型:
一氧化碳与氢气
在催化剂作用下合成甲醇的反应为:CO(g)+2H2(g) ![]() CH3OH(g)。在容积均为1L的a、b、c、d、e5个密闭容器中分别充入1mol CO和2mol H2等量混合气体,控温。实验测得相关数据如下图1和图2。
CH3OH(g)。在容积均为1L的a、b、c、d、e5个密闭容器中分别充入1mol CO和2mol H2等量混合气体,控温。实验测得相关数据如下图1和图2。
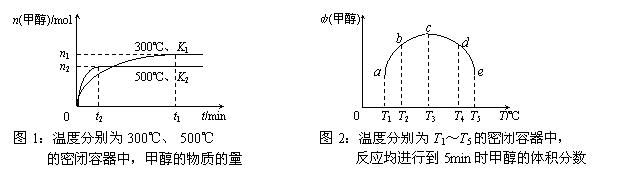
下列有关说法正确的是
A.K1>K2
B.该反应的正反应是气体体积减小的吸热反应
C.反应进行到5min时,a、b两容器中平衡正向移动,d、e两容器中平衡逆向移动
D.将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或减压
查看答案和解析>>
科目: 来源: 题型:
(10分)固体碘在水中溶解度很小,实验室配制较浓的“碘水”时常将固体碘溶于一定浓度的KI溶液中。已知:I2与KI溶液发生如下反应:I2(aq)+I¯(aq) ![]() I3¯(aq),该反应平衡常数随温度升高而减小。
I3¯(aq),该反应平衡常数随温度升高而减小。
(1)下列有关说法正确的是 ▲ 。
 A.反应:I2(aq)+I¯(aq)
A.反应:I2(aq)+I¯(aq) ![]() I3¯(aq)的△H >0
I3¯(aq)的△H >0
B. I3¯的平衡浓度[c(I3¯)]与温度T的关系如右图
C.在I2的KI水溶液中加入少量的NaOH(s)或FeCl3(s)均可使溶液中c(I3¯)减小
D.依此原理, Cl2在一定浓度的NaCl溶液中溶解度增大
(2)t℃时,将0.850 mol KI固体和0.820 mol 固体I2溶于水配成1000 mL KI-I2的水溶液,经测定该溶液中c(I2)= 0.0200 mol·L-1。
①t℃时,计算反应I2(aq)+I¯(aq) ![]() I3¯(aq)的平衡常数K(要求写出计算过程)。
I3¯(aq)的平衡常数K(要求写出计算过程)。
▲
②已知:2Na2S2O3+I2=Na2S4O6+2NaI。若取上述所配溶液2.0 mL于锥形瓶中加水稀释后,再加两滴淀粉溶液,然后用0.100 mol·L-1 Na2S2O3标准溶液进行滴定,计算滴定终点时所消耗的Na2S2O3标准溶液的体积(要求写出计算过程)。
▲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com