
科目: 来源: 题型:
下列说法不正确的是
A.活化分子具有比普通分子更高的能量
B.参加反应的物质的性质是决定化学反应速率的重要因素
C.反应物分子(或离子)间的每次碰撞是反应的先决条件
D.增大反应物浓度,可增大活化分子的百分数,所以反应速率加快
查看答案和解析>>
科目: 来源: 题型:
同质量的锌与盐酸反应,欲使反应速率增大,选用的反应条件正确的组合是( )
反应条件:①锌粒 ②锌片 ③锌粉 ④5%盐酸 ⑤10%盐酸 ⑥15%盐酸 ⑦加热 ⑧用冷水冷却 ⑨不断振荡 ⑩迅速混合后静置
A.③⑥⑦⑨ B.③⑤⑦⑨ C.①④⑧⑩ D.②⑥⑦⑩
查看答案和解析>>
科目: 来源: 题型:
在2 L的密闭容器中,在一定条件下发生如下反应: A(g)+3B(g)![]() 2C(g)。在10 min内反应物A的物质的量由1 mol降到0.6 mol,则C的化学反应速率为
2C(g)。在10 min内反应物A的物质的量由1 mol降到0.6 mol,则C的化学反应速率为
A.0.02 mol·L-1·min-1 B.0.04 mol·L-1·min-1
C.0.08 mol·L-1·min-1 D.0.4 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
用3g块状大理石与30mL3mol/L盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是: ①再加入30mL3mol/L盐酸 ②改用30mL6mol/L盐酸 ③改用3g粉末状大理石 ④适当升高温度
A.①②④ B.②③④ C.①③④ D.①②③
查看答案和解析>>
科目: 来源: 题型:
把足量铝条放入盛有一定体积的稀盐酸的试管中,可使反应速率降低且不影响H2产生量的操作是
A.加入适量CH3COONa溶液 B.加入适量KNO3溶液
C.加入适量的K2CO3溶液 D.加入适量Na2SO4溶液
查看答案和解析>>
科目: 来源: 题型:
把下列四种X溶液分别加入四个盛有10 mL 2 mol/L盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是
A、10℃20 mL 3 mol/L的X溶液 B、10℃10 mL 2 mol/L的X溶液
C、20℃10 mL 4 mol/L的X溶液 D、20℃30 mL 2 mol/L的X溶液
查看答案和解析>>
科目: 来源: 题型:
为探究Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是
A.图1实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图1所示的实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图2装置比较反应速率,可测定在相同状况下反应产生的气体体积及反应时间
 D.为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原
D.为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原
查看答案和解析>>
科目: 来源: 题型:
向某密闭容器中加入0 .3 molA 、0 .1 molC 和一定量的 B 三种气体。一定条件下发生反应,
各物质浓度随时间变化如甲图所示[t0~ t1阶段 c ( B)未画出]。附图乙为 t2时刻后改变条件
平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件
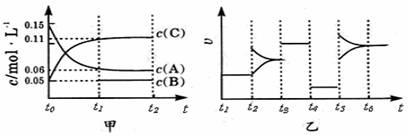 均不同。已知,t3 ~t4阶段为使用催化剂。下列说法正确的是
均不同。已知,t3 ~t4阶段为使用催化剂。下列说法正确的是
A.若t1=15 s,生成物C在t0~t1时间段的平均反应速率为0.004mol·L-1·s-1
B.t4~t5阶段改变的条件为降低反应温度 C.B的起始物质的量为 0.02mol
D.t5~t6阶段容器内A的物质的量减少0.03 mol,而此过程中容器与外界的热交换总量为akJ,该反应的热化学方程式为3A(g)![]() B(g)+2C(g);ΔH=+100akJ·mol-1
B(g)+2C(g);ΔH=+100akJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如右图。
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如右图。
4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
△H=-905 kJ·mol-1 ①
4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)
△H=-1268 kJ·mol-1 ②
下列说法中正确的是 ( )
A.工业上氨催化氧化生成 NO时,温度应控制在
780~840℃之间
B.工业上采用物料比n(O2)/n(NH3)在1.7~2.0,主要是为了提高反应速率
C.加压可提高NH3生成NO的转化率
D.N2氧化为NO的热化学方程式为:N2(g)+O2(g)![]() 2NO(g) △H=+181.5 kJ·mol-1
2NO(g) △H=+181.5 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com