
科目: 来源: 题型:
I2在KI溶液中存
在下列平衡:I2(aq)+I-(aq)![]() I3-(aq) △H =Q ,某I2、、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
I3-(aq) △H =Q ,某I2、、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是 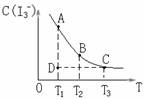
A.反应 I2(aq)+I-(aq)![]() I3-(aq) △H =Q的 Q>0
I3-(aq) △H =Q的 Q>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2则K2>K1
C.若反应进行到状态D时,一定有v正>v逆
D.状态A与状态B相比,状态A的c(I2)大
查看答案和解析>>
科目: 来源: 题型:阅读理解
(12分)
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。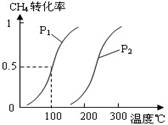
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g)![]() CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。
④该反应的△H 0,△S 0(填“<”、“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
 |
| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
| ⅰ | 150 | 1/3 | 0.1 |
| ⅱ | 5 | ||
| ⅲ | 350 | 5 |
A.请在上表空格中填入剩余的实验条件数据。
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
查看答案和解析>>
科目: 来源: 题型:
 (10分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
(10分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
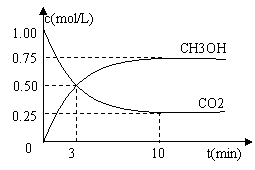
⑴.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);△H=-49.0kJ/mol
CH3OH(g)+H2O(g);△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min).
②该反应的平衡常数表达式为__________________.
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________.
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
⑵.在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O,则阴极反应式为________________________________.
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染.请你判断是否可行并说出理由______________________________________________.
查看答案和解析>>
科目: 来源: 题型:
(10分)利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O=CO+3H2。部分物质的燃烧热数据如下表:
| 物 质 | 燃烧热(kJ·mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式 。
(2)500℃、50MPa时,在容积为V L的容器中加入1 mol N2、3 mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为a。则K和a的关系是K= 。

假设在生产过程中,反应①、②、③中各有机物的转化率均为100%。且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭、甲烷各多少吨,才能满足生产需要?要有计算过程)
查看答案和解析>>
科目: 来源: 题型:
(12分)氢气是工业上重要的原料。
(1)氢气用于工业合成氨 N2(g) + 3H2(g) ![]() 2NH3(g);ΔH = -92.2 kJ·mol-1。
2NH3(g);ΔH = -92.2 kJ·mol-1。
一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t4 ﹑t5 ﹑t7时刻所对应的实验条件改变分别是
t4 t5 t7 。
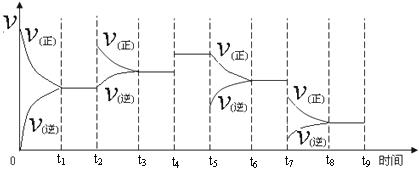 |
②温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪,此时放出热量46.1 kJ。则该温度下反应的平衡常数为 。
(2)工业上大量的氢气来源于焦炭与水蒸气高温下的反应:
C(s) + H2O(g) ![]() H2(g) + CO(g) △H = +131.3 kJ/mol
H2(g) + CO(g) △H = +131.3 kJ/mol
①该反应在低温下不能自发进行的原因是 。
②恒温,在容积可变的密闭容器中,进行如上可逆反应。一段时间后,下列物理量不发生变化时,能表明该反应已达到平衡状态的有:Ⅰ混合气体的密度;Ⅱ容器内气体的压强;Ⅲ混合气体的总物质的量; ⅣCO物质的量浓度 ( )
A.只有Ⅳ B.只有Ⅰ和Ⅳ C.只有Ⅱ和Ⅲ
D.Ⅰ、Ⅲ和Ⅳ E.都可以
(3)在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入amol及bmol碘化氢(a>b)待反应:2HI(g)![]() H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A c(I2)B ;平衡时HI的分解率αA αB ;平衡时H2在混合气体中的体积分数A B (填写“>”“<”“=”)
H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A c(I2)B ;平衡时HI的分解率αA αB ;平衡时H2在混合气体中的体积分数A B (填写“>”“<”“=”)
查看答案和解析>>
科目: 来源: 题型:
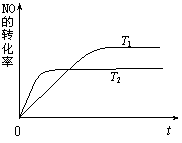
(12分)近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。
|
K= 。(计算结果保留小数点后两位数字)
⑵一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如右图所示。(已知:T1<T2)
①反应 2NO(g) ![]() N2(g)+O2(g)为(填“吸热”或“放热”) 反应。
N2(g)+O2(g)为(填“吸热”或“放热”) 反应。
②一定温度下,能够说明反应 2NO(g) ![]() N2(g)+O2(g) 已达到平衡的是(填序号) 。
N2(g)+O2(g) 已达到平衡的是(填序号) 。
a.容器内的压强不发生变化 b.NO分解的速率和NO生成的速率相等
c.NO、N2、O2的浓度保持不变 d.单位时间内分解4 mol NO,同时生成2 mol N2
⑶①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ·mol-1
△H2= 。
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:
本题列举的四个选项是4位同学在学习“化学反应的速率和化学平衡”一章后,联系工业生产
实际所发表的观点,你认为不正确的是
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
查看答案和解析>>
科目: 来源: 题型:
(8分)在一固定容积的密闭容器中,保持一定温度,在一定条件下进行下列反应:
A(g) + 2B(g) ![]() 3C(g)已知加入1 mol A和3 mol B且达到平衡时,生成了 a mol C .
3C(g)已知加入1 mol A和3 mol B且达到平衡时,生成了 a mol C .
(1)达到平衡时,C在反应混合气体中的体积分数是______________(用a表示)
(2)在相同实验条件下,若在同一容器中改加入 2mol A 和6 mol B,达到平衡后,C的物质的量为
_________mol(用a表示) .此时C在反应混合气体中的体积分数将______(填增大、减小、不变)
(3)在相同实验条件下,若在同一容器中改加入 2mol A 和8 mol B,若要求平衡后C在反应混合气
体中的体积分数不变,则还应加入C____ __mol.
查看答案和解析>>
科目: 来源: 题型:
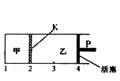 一定温度下可逆反应:A(s)+2B(g)
一定温度下可逆反应:A(s)+2B(g)![]() 2C(g)+D(g) △H<0。现将1mol A和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g) △H<0。现将1mol A和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是
A.保持温度和活塞位置不变,在甲中再加入1molA和2molB,达到新的平衡后,甲中C的浓度与乙中C的浓度相等
B.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数与甲中C的体积分数相等
C.保持温度不变,向甲中加入氦气后,甲中各物质的浓度不变
D.保持温度和乙中压强不变,向乙中加入氦气后,乙中平衡正向移动
查看答案和解析>>
科目: 来源: 题型:
(10分)二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一。
⑴ 一定条件下,2SO2(g)+O2(g)![]() 2SO3(g),向2 L密闭容器中通入2 mol SO2(g)、1 mol O2(g),2 min后反应达到平衡时,测得容器中含SO31.8mol,则该可逆反应的平衡常数K= ;恒温下,若往容器中再加入2 mol SO2(g)、1 mol O2(g), 重新达到平衡后, mol<SO3< mol。
2SO3(g),向2 L密闭容器中通入2 mol SO2(g)、1 mol O2(g),2 min后反应达到平衡时,测得容器中含SO31.8mol,则该可逆反应的平衡常数K= ;恒温下,若往容器中再加入2 mol SO2(g)、1 mol O2(g), 重新达到平衡后, mol<SO3< mol。
⑵ 用CH4催化还原NOx为N2可以消除氮氧化物的污染。现有1 L NO2、NO混合气体NOx,将其还原成N2,需同温同压下CH4的体积0.4 L,则混合气体中NO2、NO的物质量之比为 。
⑶ 新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:
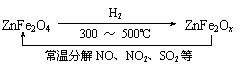
若2 mol ZnFe2Ox与SO2可生成0.75 mol S,x= 。求可分解⑵中混合气体体积V(标准状况下)。(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com