
科目: 来源: 题型:
下列事实不能用勒夏特列原理解释的是( )
A.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
B.黄绿色的氯水光照后颜色变浅
C.使用催化剂可加快SO2转化为SO3的速率
D.在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
查看答案和解析>>
科目: 来源: 题型:
已知H2(g)+I2(g)![]() 2HI(g)ΔH<0有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
2HI(g)ΔH<0有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度 B 甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D 甲增加0.1mol H2,乙增加0.1mol I2
查看答案和解析>>
科目: 来源: 题型:
![]()
|
A.该反应在T1、T3温度时达到化学平衡
B.该反应在T2温度时达到化学平衡
C.升高温度,平衡向正反应方向移动
D.该反应的正反应是吸热反应
查看答案和解析>>
科目: 来源: 题型:
反应PCl5(g)![]() PCl 3(g)+Cl2(g) ①
PCl 3(g)+Cl2(g) ①
2HI(g)![]() H2(g)+I2(g) ②
H2(g)+I2(g) ②
2NO2(g)![]() N2O4(g) ③
N2O4(g) ③
在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率( )
A.均不变 B.均增大
C.①增大,②不变,③减少 D.①减少,②不变,③增大
查看答案和解析>>
科目: 来源: 题型:
在一个固定体积的密闭容器中,加入2molA和1molB发生如下反应:2A(g)+B(g)![]() 3C(g)+D(g),达到平衡时C的浓度为wmol/L若维持体积和温度不变,按下列四种方式加入起始量,达平衡后,C仍为wmol/L的是 ( )
3C(g)+D(g),达到平衡时C的浓度为wmol/L若维持体积和温度不变,按下列四种方式加入起始量,达平衡后,C仍为wmol/L的是 ( )
A、4molA+2molB B、2molA+1molB+3molC+1molD
C、3molC+1molD+1molB D、3molC+1molD
查看答案和解析>>
科目: 来源: 题型:
(9分)在20L恒容的密闭容器中,加入3mo1SO3(g)和lmo1氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.09 mol·L-1,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3)= a mol·L-1。
(1)0min~4min内生成O2平均速率v(O2)= mol·L-1·min-1
(2)达到平衡时c(O2)=c(SO2),则a= mol·L-1
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于a mol·L-1的是
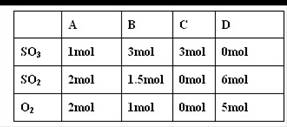
查看答案和解析>>
科目: 来源: 题型:
![]() (9分)已知可逆反应:请回答下列问题:
(9分)已知可逆反应:请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1, c(N)=2.4 mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为 ;
(2)若反应温度不变,反应物的起始浓度分别为:c(M)= 4mol·L-1,c(N)= a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a= ;
(3)若反应温度不变,反应物的起始浓度为:c(M)= c(N)= b mol·L-1,达到平衡后,M的转化率为 。
查看答案和解析>>
科目: 来源: 题型:
|
A.灯丝附近温度越低,WI2(g)的转化率越高
B.灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W,W重新沉积到灯丝上
C.该反应的平衡常数表达式是![]()
D. 利用该反应原理可以提纯钨
查看答案和解析>>
科目: 来源: 题型:
(10分)工业制硫酸生产流程如下图:
|

(1)造气阶段,为提高反应的效率,充分利用含硫矿石,请你提出两条可行的措施:
、
|
2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196 kJ·mol-1
2SO3(g) ΔH=-196 kJ·mol-1
 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,SO2的浓度是原平衡时的60%,则
达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,SO2的浓度是原平衡时的60%,则
A.平衡向逆反应方向移动了
B.SO2的转化率减小了
C.SO3的质量分数增加了
D.平衡移动过程中,v(逆)< v(正)
(3)在催化反应室,发生(2)中的反应,已知:某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。根据图示回答:
①将1.0mol SO2和0.05mol O2置于10L密闭容器中,反应达平衡后,若体系总压强为0.10 MPa。该反应的平衡常数等于 。
②平衡状态由A变到B时,平衡常数K(A) K(B) (填“>”、“<”或“=”)。
(4)增大体系的压强能使(2)中平衡向正反应方向移动,但在实际生产中采用了常压的条件,你认为可能的原因是: 。
查看答案和解析>>
科目: 来源: 题型:
(10分)将1 mol氧气和一定量的HCl放入一定体积的密闭容器中,420℃时,在
催化剂作用下发生反应:4HCl+O2 ![]() 2Cl2+2H2O。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,消耗NaOH 2.0 mol;再将剩余气体干燥后通过焦性没食子酸的碱性溶液吸收O2,溶液增重19.2 g。
2Cl2+2H2O。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,消耗NaOH 2.0 mol;再将剩余气体干燥后通过焦性没食子酸的碱性溶液吸收O2,溶液增重19.2 g。
请回答下列问题:
(1)写出平衡混合气体通入NaOH溶液中所发生反应的化学方程式。
(2)计算平衡时HCl的转化率。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com