
科目: 来源: 题型:
一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g) ![]() Y(g)+Z(s),以下能说明作为反应达到平衡标志的是
Y(g)+Z(s),以下能说明作为反应达到平衡标志的是
X的分解速率与Y的消耗速率相等
B.反应容器中压强不再变化
C.混合气体的密度不再变化
D.单位时间内生成lmolY的同时分解2mol X
查看答案和解析>>
科目: 来源: 题型:
下列说法中正确的是
A.共价化合物中一定不含有离子键,离子化合物中可能含有共价键
B.一定条件下1 mol N2与3 mol H2在密闭容器中充分反应可生成2 mol NH3
C.铁质器件附有铜质配件,在接触处易生铁锈
D.共价化合物都是由分子构成的,其熔沸点较低
查看答案和解析>>
科目: 来源: 题型:
(10分)将1 mol氧气和一定量的HCl放入2L的密闭容器中,420℃时,在催化剂作用下发生反应:4HCl+O2 ![]() 2Cl2+2H2O。5分钟后反应达到平衡,将容器中的混合气体通过过量NaOH溶液,消耗NaOH 2.0 mol;再将剩余气体干燥后通过焦性没食子酸的碱性溶液吸收O2,溶液增重19.2 g。
2Cl2+2H2O。5分钟后反应达到平衡,将容器中的混合气体通过过量NaOH溶液,消耗NaOH 2.0 mol;再将剩余气体干燥后通过焦性没食子酸的碱性溶液吸收O2,溶液增重19.2 g。
请回答下列问题:
(1)写出平衡时,混合气体通入NaOH溶液中所发生反应的离子方程式。
(2)计算0~5分钟时,Cl2的平均生成速率是多少。
(3)计算平衡时HCl的转化率。
查看答案和解析>>
科目: 来源: 题型:
在一定温度下的定容密闭容器中,下列情况表明反应A(s)+2B(g)![]() C(g)+D(g) 已达到反应限度的是
C(g)+D(g) 已达到反应限度的是
A.混合气体的密度保持不变 B.有1mol C生成的同时有1mol D生成
C.混合气体的总物质的量保持不变 D.有1 mol A生成的同时有1mol C消耗
查看答案和解析>>
科目: 来源: 题型:
在一定条件下,反应N2+3H2![]() 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
A、V(H2)=0.03mol/(L·min) B、V(N2)=0.005mol/(L·min)
C、V(NH3)=0.17mol/(L·min) D、V(NH3)=0.02mol/(L·min)
查看答案和解析>>
科目: 来源: 题型:
| 无内容 |
查看答案和解析>>
科目: 来源: 题型:
T0℃时,在2 L
的密闭容器中发生反应:X(g)+Y(g)![]() Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是
Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是
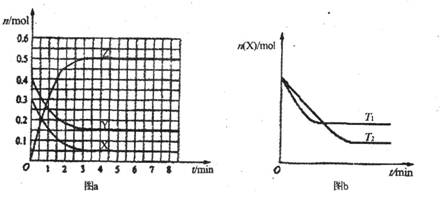
A.该反应的正反应是吸热反应
B.T0℃,从反应开始到平衡时:v(X)=0.083 mol·L-1·min-1
C.图a中反应达到平衡时,Y的转化率为37.5%
D.T1℃时,若该反应的平衡常数K=50,则T1<T0
查看答案和解析>>
科目: 来源: 题型:
(5分)23.(4分)把0.6 mol X气体和0.6 mol Y气体混合于2 L体积不变的密闭容器中,使它们发生如下反应:2X(g)+ Y(g)===nZ(g)+2W(g)。2 min末已生成0.2 mol W,若测知以Z的浓度变化表示的反应速率为0.1 mol·(L·min)-1。计算:
(1)n的值;
(2)前2min内用X的浓度变化表示的平均反应速率。
查看答案和解析>>
科目: 来源: 题型:
(8分)如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:
 (1)实验中观察到的现象是______________________________、
(1)实验中观察到的现象是______________________________、
_________________________、_________________________。
(2)产生上述现象的原因是_______________________________。
(3)写出有关反应的离子方程式___________________________。
(4)由实验推知,本实验中MgCl2溶液和H2的总能量____(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目: 来源: 题型:
(8分)氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g) ===2H2O(l) ΔH=-572kJ/mol
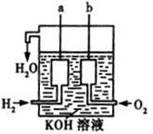 请回答下列问题:
请回答下列问题:
(1)生成物能量总和 (填“大于”、“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 (填“>”、“<”或“=”)572 kJ。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如右图所示:a、b两个电极均由多孔的碳块组成。它的负极反应物为 ,当正极消耗5.6L(标准状况)气体时,外电路转移的电子数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com