
科目: 来源: 题型:
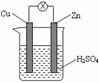 将锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池(如图所示)。下列叙述不正确的是
将锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池(如图所示)。下列叙述不正确的是
A.铜片质量不变 B.锌片发生氧化反应
C.该装置将化学能转变为电能 D.电流从锌片流向铜片
查看答案和解析>>
科目: 来源: 题型:
(8分)氢气燃烧生成液态水的热化学方程式是
2H2(g)+O2(g) ==2H2O(l) ΔH=-572kJ/mol 。 请回答下列问题:
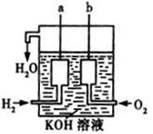 (1)生成物能量总和 (填“>”、“<”或“=”)反应物能量总和。
(1)生成物能量总和 (填“>”、“<”或“=”)反应物能量总和。
(2)若1mol氢气完全燃烧生成水蒸气,则放出的热量 _(填“>”、“<”或“=”)286 kJ。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造的一部分如右图所示:a、b两个电极均由多孔的碳块组成。此装置的负极反应式为 ,当正极消耗5.6L(标准状况)气体时,外电路转移的电子数为 。
查看答案和解析>>
科目: 来源: 题型:
如右图所示,把锌片和铜片用导线相连后插入稀硫酸溶液
中构成原电池。下列叙述正确的是
 A.该装置将化学能转变为电能 B.电流从锌片流向铜片
A.该装置将化学能转变为电能 B.电流从锌片流向铜片
C.一段时间后,铜片质量减轻 D.锌片发生还原反应
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式表达正确的是
A.用惰性电极电解氯化镁溶液:![]()
B.将氯化亚铁溶液和稀硝酸混合:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
C.碳酸氢铵溶液与足量氢氧化钠溶液反应: + OH-NH3·H2O
D.NaAlO2溶液中通入过量CO2:2AlO2— + CO2 + 3H2O === 2Al(OH)3↓ + CO32—
查看答案和解析>>
科目: 来源: 题型:
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见右图,电池总反应可表示为:2H2+O2
 =2H2O,下列有关说法正确的是
=2H2O,下列有关说法正确的是
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e-=4OH-
C.每转移0.1 mol电子,消耗1.12 L的H2
D.H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目: 来源: 题型:
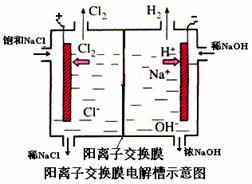
(10分)工业上生产氯气,常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。
⑴这种阳离子交换膜,只允许溶液中的 ▲ 通过。(填下列微粒的编号)
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]()
⑵写出在电解过程中阳极发生的电极方程式: ▲ 。
⑶已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为
▲ 。
 | |||
 | |||
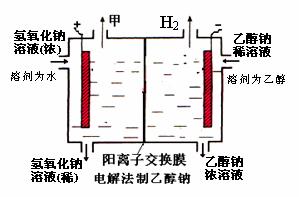
⑷某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇。回答下列问题:
①写出在电解过程中阴极发生的电极方程式 ▲ 。
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是: ▲ 。
查看答案和解析>>
科目: 来源: 题型:
(3分)如图:以一铜锌合金为阳极,一纯铜为阴极(起始时两电极质量相等),
进行电解,电解液为硫酸铜溶液,当外电路有1.806×1023个电子转移时,
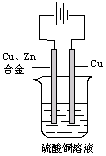 阴极比阳极重19.25g ,求铜锌合金中铜的质量分数。
阴极比阳极重19.25g ,求铜锌合金中铜的质量分数。
(已知:电极反应式为 阳极: Zn-2e-=Zn2+、Cu-2e-=Cu2+
阴极:Cu2+ +2e-=Cu )
查看答案和解析>>
科目: 来源: 题型:
| 无内容 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
(10分)
近期因“召回门”而闹的沸沸扬扬的丰田Prius属第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1 mol水蒸气放热569.1 kJ。则该反应的热化学方程式为_________________________________。
 (2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理示意如图,其总反应式是:
(2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理示意如图,其总反应式是:
![]()
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH将_______(填“增大”、“不变”或“减小”),该电极的电极反应式为_________________。
(3)汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度:
CO(g)+1/2O2(g) ![]() CO2(g)。
CO2(g)。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请填写表中的空格。
| 容器编号 | c(CO)/mol·L-1 | c (O2)/mol·L-1 | c (CO2)/mol·L-1 | v(正)和v (逆) 比较 |
| I | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 |
②相同温度下,某汽车尾气中CO、CO2的浓度分别为1.0×10-5mol·L-1和1.0×10-4mol·L-1。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×10-4mol·L-1,则最终尾气中CO的浓度为_________mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
下列有关叙述:① 非金属单质N能从M的化合物中置换出非金属单质M;② M原子比N原子容易得到电子;③两元素的阴离子在电极上放电时,N-优先于M-;④气态氢化物水溶液的酸性HmM>HnN;⑤氧化物水化物的酸性HmMOx>HnNOy;⑥单质熔点M>N。能说明非金属元素M比N的非金属性强的是
A.②⑤ B.②③? C.①②③ D.①②③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com