
科目: 来源: 题型:
|
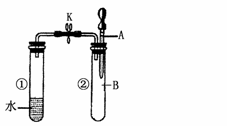
(1)铁片上的现象是 ,电极反应式 。
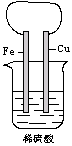 (2)铜片上的现象是 ,电极反应式 。
(2)铜片上的现象是 ,电极反应式 。
(3)写出该电池总反应的离子方程式 。
(4) Fe2+ 向 (填具体电极)移动,溶液中的pH (填“变大”或“变小”)。
查看答案和解析>>
科目: 来源: 题型:
(5分)如图:以一铜锌合金为阳极,一纯铜为阴极(起始时两电极质量相等),
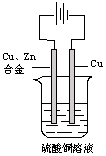 进行电解,电解液为硫酸铜溶液,当外电路有1.806×1023个电子转移时,
进行电解,电解液为硫酸铜溶液,当外电路有1.806×1023个电子转移时,
阴极比阳极重19.25g ,求铜锌合金中铜的质量分数。
(已知:电极反应式为 阳极: Zn-2e-=Zn2+、Cu-2e-=Cu2+
阴极:Cu2+ +2e-=Cu )
查看答案和解析>>
科目: 来源: 题型:
(6分)(1)研究性学习小组为了证明铁的金属性比铜强,他设计了如下几种方案,其中合理的是 (填序号)
A.铁片置于硫酸铜溶液中有铜析出;
B.铁、铜与氯气反应分别生成FeCl3、CuCl2;
C.铜片置于FeCl3溶液中,铜片逐渐溶解(2FeCl3+Cu=2 FeCl2+ CuCl2)
D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡
E.常温下,分别将铁片和铜片置于浓硝酸中,铁片不溶解,而铜片溶解
(2)请你另设计一个能证明铁的金属活动性比铜强的实验。要求:
a.此方案的原理不同于上述任一合理方案;
b.绘出实验装置图并注明所需的药品;
c.写出实验过程中的主要实验现象。
答: 实验装置 实验现象
 |  |
查看答案和解析>>
科目: 来源: 题型:
(7分)(1)铜板上铁铆钉处容易生锈,称为 腐蚀,被腐蚀的金属是 ,为 极;原电池的正极电极反应式是 。
(2)如图所示的铜-锌原电池中,理论上应观察到的现象是:铜片上: ,此时原电池的负极电极反应式是
(3)在相同温度下,同样大小的混有碳粒等杂质的锌比纯锌与同浓度同体积的稀硫酸反应的速率 (选填“要快”、“要慢”、“相等”、“无法确定”)
查看答案和解析>>
科目: 来源: 题型:
(10分)按右图所示装置,以石墨为电极电解氯化铜溶液。
(1)阴极为 (“A”或“B”), 发生反应的微粒 ,阴极电极反应式
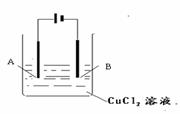 (2)如要用电解的方法精炼铜,电解液选用CuSO4溶液,则阳极的材料是 (填写“粗铜”或“纯铜”) ,阳电极反应式为 。
(2)如要用电解的方法精炼铜,电解液选用CuSO4溶液,则阳极的材料是 (填写“粗铜”或“纯铜”) ,阳电极反应式为 。
查看答案和解析>>
科目: 来源: 题型:
 三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量Na2SO4后进行电解,电解过程中产生的Cl2在弱碱条件下生成ClO-,把二价镍氧化成三价镍。以下说法正确的是( )
三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量Na2SO4后进行电解,电解过程中产生的Cl2在弱碱条件下生成ClO-,把二价镍氧化成三价镍。以下说法正确的是( )
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应方程式为:2 Cl- + 2e- = Cl2
D.2 mol二价镍全部转为三价镍时,外电路中通过了2 mol电子
查看答案和解析>>
科目: 来源: 题型:
根据下列实验现象,所得结论正确的是 ( )
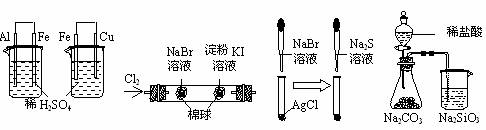
A B C D
| 实验 | 实验现象 | 结论 |
| A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 白色固体先变为淡黄色,后变为黑色 | 溶解性:AgCl>AgBr>Ag2S |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
查看答案和解析>>
科目: 来源: 题型:
(10分)MnO2和锌是制造干电池的主要原料。某地有软锰矿和闪锌矿两座矿山,它们的主要成份为:
软锰矿:MnO2含量≥65% Al2O3含量为4%
闪锌矿:ZnS含量≥80% FeS、 CuS、 CdS含量各为2%
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液经净化后再进行电解,MnO2在电解池的阳极析出。
电解锌的传统生产工艺为:闪锌矿高温氧化脱硫再用热还原法还原得粗锌:
2ZnS+O2![]() 2ZnO+2SO2 2C+O2
2ZnO+2SO2 2C+O2![]() 2CO ZnO+CO
2CO ZnO+CO![]() Zn(g)+CO2
Zn(g)+CO2
将用热还原法制得的粗锌溶于硫酸,再电解ZnSO4溶液可生产纯度为99.95%的锌。
现在生产MnO2和锌的新工艺主要是通过电解获得MnO2和锌,副产品是硫、金属铜和镉。简化流程杠图如下:

试回答下列问题:
(1)Zn的原子序数为30,它在元素周期表中的位置是 ;软锰矿、闪锌矿粉未与硫酸溶液共热时析出硫的反应为氧化-还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,据此写出MnO2在酸性溶液中分别FeS发生氧化-还原反应的化学方程式 ;软锰矿中Al2O3溶于硫酸的离子方程式 ;由滤渣甲回收硫黄的实验方法是 ;
(2)用离子方程式表示浸出液A与适量Zn粉作用得到滤液B与滤渣乙的过程
______________________________________________________________________
(3)滤渣丙的化学成分是 ;
(4)用铁和铂电极电解MnSO4和ZnSO4的混合溶液可以得到Zn和MnO2,电解时,铁做 极,铁极发生的电极反应为 。
查看答案和解析>>
科目: 来源: 题型:
(10分)在一定条件下(不需添加别的反应物),经不同的化学反应,可实现如下图的各种变化。其中,反应③是工业生产中的一个重要反应,反应③④为氧化还原反应,而反应①②为非氧化还原反应。X、F和Y为单质,其余为化合物;气体D的水溶液呈碱性,F是空气的主要成份之一,据此请填空:

⑴如果物质A是一种酸式盐,则其化学式为 ,构成F单质的原子的核外电子排布式是 。
(2) 写出B与W按物质的量1:1反应生成G的离子方程式 。
(3) 写出反应③的化学方程式,并注明反应条件 。
(4) 写出反应④的化学方程式,并注明反应条件 。
查看答案和解析>>
科目: 来源: 题型:
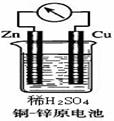
如右图所示,把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池。下列叙述正确的是
 A.Zn是负极,发生还原反应
A.Zn是负极,发生还原反应
B.电流从锌片流向铜片
C.一段时间后,铜片质量减轻
D.该装置将化学能转变为电能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com