
科目: 来源: 题型:
(10分)
2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂。某回收工艺流程如下:
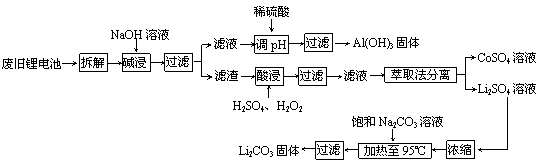 |
(1)上述工艺回收到的产物有 。
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是_______________。
(3)碱浸时主要反应的离子方程式为_____________________。
(4)酸浸时反应的化学方程式为___________。如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处是_______________。
(5)生成Li2CO3的化学反应方程式为____________。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应____________。
查看答案和解析>>
科目: 来源: 题型:
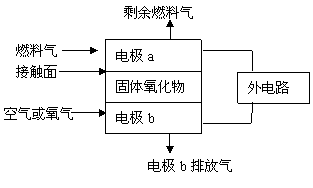 固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,其工作原理如图所示。下列关于固体燃料电池的有关说法正确的是
固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,其工作原理如图所示。下列关于固体燃料电池的有关说法正确的是
A.电极b为电池负极,电极反应式为O2+4e—=2O2—
B.固体氧化物的作用是让电子在电池内部通过
C.若H2作燃料气,接触面上发生的反应为:H2+2OH——2e—=2H2O
D.若C2H4作燃料气,接触面上发生的反应为:C2H4+6O2——12e—=2CO2+2H2O
查看答案和解析>>
科目: 来源: 题型:
(11分)在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示,试回答下列问题:
 |
⑴ 该合成路线对于环境保护的价值在于 。
 ⑵ 15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂。
⑵ 15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂。
用离子方程式表示乙醇胺水溶液呈弱碱性的原
因: 。
⑶ CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=
-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化
学方程式: 。
⑷ 科学家发明了一种基于右图所示原理的廉价光电化学电池
装置,写出光照时半导体电极表面发生的电极反应
式 。目前应用最多的半
导体材料是Si,甚至有人提出硅是“21世纪的能源”,硅可
作为新能源的原因可能的是 。
a.在自然界中存在大量的单质硅 b.硅可以通过化学方法“再生”
c.硅具有较强的亲氧性,燃烧放出的热量多 d.硅的化学性质不活泼,便于安全运输、贮存
查看答案和解析>>
科目: 来源: 题型:阅读理解
(12分)(1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题:
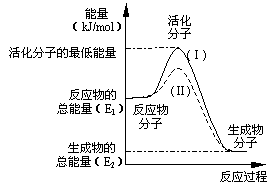 ①图中所示反应是_____________(填“吸热”
①图中所示反应是_____________(填“吸热”
或“放热”)反应,该反应____________
(填“需要”或“不需要”)加热,该反应的
△H=____________(用含E1、E2的代数式表示)。
②已知热化学方程式:H2(g)+1/2O2(g)=H2O(g);
△H=-241.8 kJ/mol。该反应的活化能为
167.2kJ/mol,则其逆反应的活化能为____________。
③对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,
活化能大大降低,活化分子的百分数增多,反应速率明显加快,你认为最可能的原因是_________ ____________________________________________。
(2)随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求。
①有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
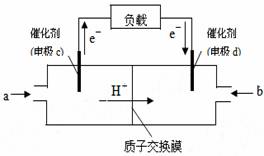 ②下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。
②下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。
甲醇在催化剂作用下提供质子和电子,电子经外电路、
质子经内电路到达另一极与氧气反应,电池总反应为:
2CH3OH+3O2=2CO2+4H2O。则c电极是
(填“正极”或“负极”),c电极上发生的电极反应式
是 。
查看答案和解析>>
科目: 来源: 题型:
(12分)右图是一个化学过程的示意图。已知甲池的总反应式为:
|
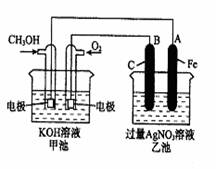
(1)请回答图中甲、乙两池的名称。
甲电池是 装置,
乙池是 装置。
(2)请回答下列电极的名称:
通入CH3OH的电极名称是 ,
B(石墨)电极的名称是 。
(3)写出电极反应式:
通入O2的电极的电极反应式是 。A(Fe)电极的电极反应式为
,
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)
查看答案和解析>>
科目: 来源: 题型:
用石墨电极电解500mLNaNO3和Cu(NO3)2的混合溶液。通电一段时间后,阴、阳两极逸出的气体在标准状况下的体积分别为11.2L和8.4L,求原溶液中Cu2+的物质的量浓度(假设溶液的体积不变)
A.1.25 mol•L-1 B.2.5 mol•L-1 C.0.50 mol•L-1 D.1.0 mol•L-1
查看答案和解析>>
科目: 来源: 题型:
(10分)如图,X和Y均为石墨电极:
(1)若电解液为滴有酚酞的饱和食盐水,
电解反应的离子方程式为:
电解过程中 极(填阴或阳)附近会出现红色;
 (2)若电解液为500mL含A溶质的某蓝色溶液,电解一段时间,观察到x电极表面有红色固态物质生成,Y电极有无色气体生成;当溶液中原有溶质完全电解后,取出x电极,洗涤、干燥、称量,电极增重1.6g。
(2)若电解液为500mL含A溶质的某蓝色溶液,电解一段时间,观察到x电极表面有红色固态物质生成,Y电极有无色气体生成;当溶液中原有溶质完全电解后,取出x电极,洗涤、干燥、称量,电极增重1.6g。
①电解后溶液的pH= ;要使电解后溶液恢复到电解前的状态,需加入一定量的
(填物质的化学式)(假设电解前后溶液的体积不变)。
②请你推测原溶液中所含的酸根离子可能是 ;并设计实验验证你的推测,写出实验的操作步骤、现象和结论
。
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是
A. 液晶是晶体
B. 电解氯化铜溶液时,电池的阴极电极反应式是2Cl--2e-=Cl2↑
C. 热化学方程式CaCO3(s)=CaO(s)+CO2(g) ΔH=+178.5 KJ·mol-1 的意义是表示有1mol CaCO3完全分解生成1mol CaO和1mol CO2气体要放出178.5 KJ的热量
D. 熔融NaCl,MgO晶体时克服的作用力相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com