
科目: 来源: 题型:
在32 16S2-中,质子数为 ,中子数为 ,电子数为: ;画出该离子的结构示意图 ,该元素在元素周期表中的位置是第 周期 族,该元素的最高价氧化物对应水化物的化学式是: 。
查看答案和解析>>
科目: 来源: 题型:
(6分)( 1 )下列7种物质:A. P4(白磷), B.SiO2, C.NH4Cl,D.Ca(OH)2,E.NaF,
F.CO2, G.金刚石 ,固态下都为晶体,回答下列问题:(填写化学式)
① 熔化时不需要破坏化学键的是 ,熔化时需要破坏共价键的是
② 晶体中既有离子键又有共价键的是 ;
③ 熔点最高的晶体是
( 2 ).某元素最高正化合价为+6,其最低负价为________。某元素R与氢形成的气态氢化 物的化学式为RH3,其最高价氧化物的化学式为____________。
查看答案和解析>>
科目: 来源: 题型:
![]() 下表是周期表中的一部分,根据A—N在周期表中的位置,按要求回答下列问题:(用相关的元素符号或分子式表示)
下表是周期表中的一部分,根据A—N在周期表中的位置,按要求回答下列问题:(用相关的元素符号或分子式表示)
|
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | M |
(1)表中元素,只有负价而无正价的元素是 ,氧化性最强的单质是 ,化学性质最不活泼的元素是________,金属性最强的单质与水反应的化学方程式是____________________________________。
(2) 最高价氧化物的水化物酸性最强的是 ________ ,呈两性的是 ;
(3)元素F形成的稳定的氧化物在呼吸面具中供氧时的化学方程式是 ,该化合物的颜色为_________色。
(4)元素M的单质和石灰乳作用可制成有漂白和消毒作用的漂白粉, 用化学方程式表示漂白粉在潮湿空气中起漂白作用的原理
查看答案和解析>>
科目: 来源: 题型:
A、B、C为短周期元素,在周期表中所处位置如下图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
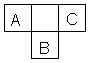 (1)写出A、B、C三种元素的名称 、 、 。
(1)写出A、B、C三种元素的名称 、 、 。
(2)B位于元素周期表第 周期,第 族。
(3)C的原子结构示意图为 。
(4)比较B、C的的原子半径,B C,写出A的气态氢化物与B的最高价氧
化物的水化物反应的化学方程式
(5)A的单质的电子式为 ,其中的化学键属于 键(填“离子”或“共价”)。
查看答案和解析>>
科目: 来源: 题型:
(13分)下表是元素周期表的短周期部分,表中字母分别表示一种元素。请回答下列问题:
| a |
|
| |||||
|
|
|
| b | c | d |
|
|
| e |
| f |
|
| g |
|
|
(1) f元素在周期表中的位置是 周期 族。
(2) b元素形成的同素异形体的晶体类型可能是(填序号)__________。
① 原子晶体 ② 离子晶体 ③ 分子晶体 ④ 金属晶体
(3)e在空气中燃烧的产物所含化学键的类型为__________、__________。
(4) 化合物ca3的电子式为 ,ca3的催化氧化反应的化学方程式为 ,若有1.25 mol 电子发生转移,则参加反应的ca3的体积为 L(标准状况)。
(5) a、c、d中的两种元素可组成具有10电子的多种分子和离子,写出其中两种离子反应生成两种分子的离子方程式 。
(6) 由a、b、c、g四种元素中的三种元素组成的某种化合物,可与其中的第四种元素的单质发生反应,该反应的化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:
(12分)
原子数相同、电子总数相同的分子,互称为等电子体。
Ⅰ.已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、6和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1 :2。
请回答:
(1)组成A分子的原子的元素符号是 ;已知E是有毒的有机物,E的熔、沸点比CH4的熔、沸点高,其主要原因是____________________________________。
(2)C的立体结构呈 ____ 形,该分子属于 ____ 分子(填“极性”或“非极性”);
(3)火箭中可充入四氧化二氮和D作为燃料反应生成氮气和水,该反应的化学方程式为_______ __________________ 。(不需要写反应条件)
Ⅱ.CO与N2互为等电子体。
(4)CO的总键能大于N2的总键能,但CO比N2容易参加化学反应。
根据下表数据,说明CO比N2活泼的原因是____________________________________。
| A-B | A=B | A≡B | ||
| CO | 键能(kJ/mol) | 357.7 | 798.9 | 1071.9 |
| 键能差值kJ/mol) | 441.2 273 | |||
| N2 | 键能(kJ/mol) | 154.8 | 418.4 | 941.7 |
| 键能差值kJ/mol) | 263.6 523.3 | |||
(5)它们的分子中都包含___________个σ键,______________个π键。
(6)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关。
Ni原子的价电子排布式为 _____ 。Fe(CO)5常温下呈液态,熔点为
-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ____(填晶体类型);Fe(CO)5是配合物,配体是__________ 。
查看答案和解析>>
科目: 来源: 题型:
(12分)A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其轨道表示式为 ;A元素的气态氢化物可以和酸反应,形成一个5核10电子的阳离子,写出该阳离子的结构式:_______________________。
(2)B元素单质的一种同素异形体是自然界硬度最大的物质,C元素单质的一种同素异形体是空气中含量最多的物质,则BC2的电子式为___________。B元素单质形成的同素异形体的晶体类型可能是(填序号) 。
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体 ⑤混合晶体
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为 ,D元素在周期表中的第_______周期,第_________族,其基态原子的外围电子排布式为 。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为 ,其原子结构示意图为 。
查看答案和解析>>
科目: 来源: 题型:
(12分)下表是元素周期表的一部分,其中所列字母分别代表某一元素。
| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| p | e | f | g | h | |||||||||||||
| i | |||||||||||||||||
用表中所给的元素,回答下列问题:
(1)c、d、g、h元素的氢化物中,沸点最高的是 (填分子式)。
(2)比较e、f单质及ef形成的合金,三者硬度由大到小的顺序(填写名称):
(3)原子核外s电子总数比p电子总数少4个的元素为 (填写元素符号),用电子式表示它和p元素形成化合物的过程_______________________________________。
(4)表中所给元素中第一电离能最大的元素是___________(填写元素符号)。
(5)1906年的诺贝尔化学奖授予为制备F2单质作出重大贡献的化学家莫瓦桑,你认为最先用来与F2反应制备稀有气体化合物的元素是 (填写元素符号)。
查看答案和解析>>
科目: 来源: 题型:
(8分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:w.w.w.k.s.5.u.c.o.m
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)⑨、⑩的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑥中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中④、⑩两种元素形成的氢化物中沸点高的是 ,说明原因:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com