
科目: 来源: 题型:
| 无内容 |
查看答案和解析>>
科目: 来源: 题型:
以NA代表阿伏加德罗常数的值,则关于热化学方程式
![]() ;△H=-1300kJ/mol的说法中,正确的是 ( )
;△H=-1300kJ/mol的说法中,正确的是 ( )
A.有10NA个电子转移时,放出1300kJ的能量
B.有NA个水分子生成且为液体时,吸收1300kJ的能量
C.有2NA个碳氧共用电子对生成时,放出1300kJ的能量
D.有8NA个碳氧共用电子对生成时,放出1300kJ的能量
查看答案和解析>>
科目: 来源: 题型:
(6分)把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g) == CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s) +H2O(g) == CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2 (g) == 2CO2(g) △H3<0 ③
2H2(g)+O2 (g) == 2H2O(g) △H4<0 ④
请回答下列问题:
(1) 途径I放出的热量 ( 填“大于”“等于”或“小于”) 途径II放出的热量。
(2) △H1、△H2、△H3、△H4的数学关系式是 。
(3)煤炭作为燃料采用途径II的优点有 。
查看答案和解析>>
科目: 来源: 题型:
下列变化为放热反应的是
A、能量变化如右图所示的化学反应
B、2HI(g)=H2(g)+I2(g) △H=+14.9 kJ/mol
C、形成化学键时共放出能量862 kJ的化学反应
D、H2O(g)=H2O(l) △H=-44.0 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
火箭推进器常以联氨(N2H4)为燃料、过氧化氢为助燃剂。已知下列各物质反应的热化学方程式:
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH1=-533.23 kJ·mol-1
H2O(g)=H2O (l) DH2=–44 kJ·mol-1
2H2O2(l)=2H2O(l)+ O2(g) DH3=–196.4 kJ·mol-1
则联氨与过氧化氢反应的热化学方程式可表示为
A.N2H4(g)+2H2O2(l)= N2(g)+4H2O(l) ΔH=+817.63 kJ·mol-1
B.N2H4(g)+2H2O2(l)= N2(g)+4H2O(g) ΔH=-641.63 kJ·mol-1
C.N2H4(g)+2H2O2(l)= N2(g)+4H2O(l) ΔH=-641.63 kJ·mol-1
D.N2H4(g)+2H2O2(l)= N2(g)+4H2O(g) ΔH=-817.63 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
(12分)多晶硅
(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环
境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为
BaCO3,且含有钙、铁、镁等离子)制备BaCl2·2H2O,工艺流程如下。已知常温下Fe3+、Mg2+完全沉淀的
pH分别是:3.4、12.4。 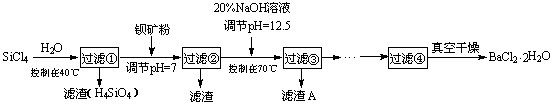
(1)SiCl4水解控制在40℃以下的原因是 ▲ 。
已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g) ΔH1=47 kJ/mol
SiHCl3(s)+H2(g)=Si(s)+3HCl(g) ΔH2=189 kJ/mol
则由SiCl4制备硅的热化学方程式为 ▲ 。
(2)加钡矿粉时生成BaCl2的离子反应方程式是 ▲ 。
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是 ▲ ,控制温度70℃的目的是 ▲ 。
(4)BaCl2滤液经蒸发浓缩、降温结晶、过滤,再经真空干燥后得到·2H2O。实验室中蒸发浓缩用到的含硅酸盐的仪器有 ▲ 种。
(5)为体现该工艺的绿色化学思想,该工艺中能循环利用的物质是 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
(10分)
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
⑴烟气脱硫、脱硝的环境意义是 ▲ 。
⑵选择性催化还原法的脱硝原理为:
6NOx+4x NH3 ![]() (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
①上述反应中每转移3mol电子,生成标准状况下N2的体积为 ▲ L。
②已知:2H2(g)+O2(g) =2H2O (g) ΔH=-483.6 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) ΔH=-92.4 kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=-180.5kJ·mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的ΔH= ▲ 。
⑶目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。

图1 图2
①写出该脱硝原理总反应的化学方程式: ▲ 。
②为达到最佳脱硝效果,应采取的条件是 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
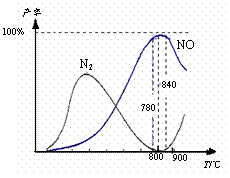 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如右图。
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如右图。
4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
△H=-905 kJ·mol-1 ①
4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)
△H=-1268 kJ·mol-1 ②
下列说法中正确的是
A.工业上氨催化氧化生成 NO时,温度应控制在
780~840℃之间
B.工业上采用物料比n(O2)/n(NH3)在1.7~2.0,主要是为了提高反应速率
C.加压可提高NH3生成NO的转化率
D.N2氧化为NO的热化学方程式为:N2(g)+O2(g)![]() 2NO(g) △H=+181.5 kJ·mol-1
2NO(g) △H=+181.5 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:阅读理解
(12分)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有 。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。
 |
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
(4)测定某K2FeO4溶液浓度的实验步骤如下:
步骤1:准确量取V mL K2FeO4溶液加入到锥形瓶中
步骤2:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-
步骤3:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+
步骤4:加入二苯胺磺酸钠作指示剂,用c mol·L-1 (NH4)2Fe(SO4) 2标准溶液滴定至终点,消耗(NH4)2Fe(SO4) 2溶液V1 mL。滴定时发生的反应为:Fe2++Cr2O72-+H+→Fe3++Cr3++H2O(未配平)
① 写出步骤2中发生反应的离子方程式 。
② 根据上述实验数据,测定该溶液中K2FeO4的浓度为 mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
(10分)铝、铁、铜是应用最普遍的金属。
(1)铜是印刷电路工业的重要材料。用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,是工业上采用的方法之一。已知
Cu(s) + 2H+(aq) == Cu2+(aq) + H2(g) △H= +64.39kJ/mol
2H2O2(l) == 2H2O(l) + O2 (g) △H= ﹣196.46kJ/mol
H2(g) +1/2 O2 (g)== H2O(l) △H= ﹣285.84kJ/mol
在H2SO4溶液中Cu和H2O2反应生成Cu2+和H2O的热化学方程式为
(2)镁铝合金生活中应用广泛。取样品a克,溶于200ml 5mol/L的HCl溶液,收集到标况下氢气3.36L,a的取值范围 ,向反应后溶液中加入4mol/L NaOH溶液 ml,沉淀质量达到最大值。
(3)标准状况下,铁铜合金ag加入足量稀硝酸中,收集了一定量气体NO,在混合了67.2mlO2后,可完全被H2O吸收,无气体剩余。则生成的NO为 ml;向反应后溶液加足量的NaOH溶液,得到沉淀的质量 g。(用含a的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com