
科目: 来源: 题型:
(14分)现有金属单质A、B、C、I和气体甲、乙、丙及物质D、E、F、G、H。其中B是地壳中含量最多的金属。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。

 请根据以上信息回答下列问题:
请根据以上信息回答下列问题:
⑴写出下列物质的化学式: C 、H
⑵写出反应③的化学方程式:
写出反应⑦的离子方程式:
(3)实验室检验物质G中阳离子的常用试剂是:
(4)工业上按右图所示方法以甲和乙为原料制取丙。为此通入气体的合理方式是:a处通入______(填分子式),b处通入_______(填分子式);同时应采取的措施是:___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
有氧化镁、氧化铝的混合物完全溶于200mL盐酸,而后逐滴加入1.0mol·L-1的NaOH溶液。当加入的NaOH的体积V1=20mL时,开始有沉淀析出,且沉淀量随NaOH加入量逐渐增加。当NaOH的体积V2=520mL时,沉淀量达最大值,继续滴加NaOH时,沉淀量逐渐减小。当V3=620mL时,沉淀量不再减少。
(1)最初加入的20mL NaOH溶液的作用是什么?
(2)所用盐酸的物质的量浓度为多少?
(3)氧化镁、氧化铝物质的量比为多少?
查看答案和解析>>
科目: 来源: 题型:
 (10分)下图表示淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。Ks5u
(10分)下图表示淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。Ks5u
(1)写出A在加热条件下与H2反应的化学方程式
▲ ;
(2)写出E与A的氢化物反应生成A的化学方程式
▲ ;
(3)写出一个由D生成B的化学方程式 ▲ ;
(4)将5mL0.10mol·L-1的E溶液与10mL0.10 mol·L-1的NaOH溶液混合。写出反应的离子方程式 ▲ ;
(5)E溶液久置于空气中,溶液pH将 ▲ (填“变大”、“不”变、 “变小”),用化学方程式说明理由 ▲ ;
查看答案和解析>>
科目: 来源: 题型:
 (8分)关于硬铝废料(含90%铝、2.5%镁、7.5%铜)的利用,某探究小组进行了下列实验。
(8分)关于硬铝废料(含90%铝、2.5%镁、7.5%铜)的利用,某探究小组进行了下列实验。
试回答下列问题:
(1)写出晶体A的一种用途 ▲ ,写出晶体B的化学式 ▲ 。
(2)写出反应①、②、③的离子方程式。
① ▲ ② ▲ ③ ▲
查看答案和解析>>
科目: 来源: 题型:
 (8分)利用生产钛白的副产品绿矾(FeSO4•7H2O)制备还原铁粉的步骤如下:将绿矾溶于稀硫酸溶液,向其中滴加(NH4)2CO3溶液,得到FeCO3•nH2O沉淀,静置,过滤,洗涤,干燥,再将FeCO3与煤粉一起焙烧,最终制得还原铁粉。涉及的主要反应有:FeCO3
(8分)利用生产钛白的副产品绿矾(FeSO4•7H2O)制备还原铁粉的步骤如下:将绿矾溶于稀硫酸溶液,向其中滴加(NH4)2CO3溶液,得到FeCO3•nH2O沉淀,静置,过滤,洗涤,干燥,再将FeCO3与煤粉一起焙烧,最终制得还原铁粉。涉及的主要反应有:FeCO3 ![]() FeO + CO2, C+CO 2
FeO + CO2, C+CO 2![]() 2CO, CO + FeO
2CO, CO + FeO![]() Fe + CO2,Ks5u
Fe + CO2,Ks5u
(1)检验绿矾是否已有部分氧化的方法是 ▲ 。
(2)证明沉淀已经洗涤干净的方法是 ▲ 。
(3)干燥过程中少量FeCO3•nH2O被氧化为FeOOH,反应方程式为: ▲ 。
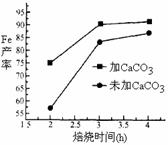
(4)实际生产中,所得沉淀仍含少量硫酸盐,在焙烧过程中需加入CaCO3进行脱硫处理,下图为加CaCO3和不加CaCO3对还原铁粉的产率的影响,根据图像分析,CaCO3的另一作用为 ▲ 。Ks5u
查看答案和解析>>
科目: 来源: 题型:
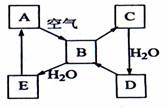
![]() (11分)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并有硫酸生成,其过程如图:
(11分)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并有硫酸生成,其过程如图:
(1)该过程的化学反应方程式为 ▲ 。
(2)人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜和溶液X,该过程中发生的离子反应方程式(请将①补充完整):
①□Cu2S+□Fe3++□H2O![]() □Cu2++□Fe2++□( )+□SO42-
□Cu2++□Fe2++□( )+□SO42-
② ▲ 。
(3)在上述所得溶液X中加入Na2O2固体,可以观察到的实验现象为 ▲ 。写出Na2O2与水反应的化学方程式 ▲ 。
(4)请评价细菌冶金的优点 ▲ 。(说一点即可)
查看答案和解析>>
科目: 来源: 题型:
(1)(3分)下列实验操作中正确的是(填写序号)_______________________。
A.蒸发操作时,待蒸发皿中的水分完全蒸干后再停止加热
B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
D.把氢氧化钠固体放在托盘天平左盘的滤纸上称量
E.过滤操作中,为了加快过滤可用玻璃棒在漏斗中轻轻搅拌
F.配制溶液时,为了准确,溶解后应立即将溶液沿玻璃棒引流转移至容量瓶内
G.为加速固体物质的溶解可采用粉碎、振荡、搅拌、加热等方法
(2)(8分)除去下表各溶液中含有的少量杂质(括号内)填写下表:
| 物质(杂质) | 除杂质所需试剂(要注明用量) | 离子方程式 |
| Fe2O3(Al2O3) | ||
| FeCl2溶液(FeCl3) | ||
| Na2CO3溶液(NaHCO3) | ||
| NaHCO3溶液(Na2CO3) |
查看答案和解析>>
科目: 来源: 题型:
(10分)已知某纯碱(Na2CO3)试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
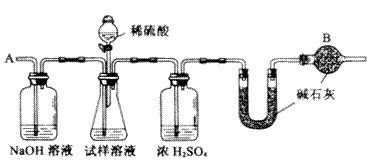
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;
②将a g试样放人锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
③称量盛有碱石灰的U型管的质量,得到b g;
④从分液漏斗滴人6 mol·L-1 的硫酸,直到不再产生气体时为止;
⑤从导管A处缓缓鼓人一定量的空气;
⑥再次称量盛有碱石灰的U型管的质量,得到c g;
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g;
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明
(2)装置中干燥管B的作用是
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果将 (填偏高、偏低或不变)
(4)步骤⑤的目的是
(5)步骤⑦的目的是
(6)该试样中纯碱的质量分数的计算式为
查看答案和解析>>
科目: 来源: 题型:
(13分)下列图中是中学化学的常见物质,其中E、F、G、Z、W是单质,B的化学式是E2F3。它们有如下图所示的转化关系:
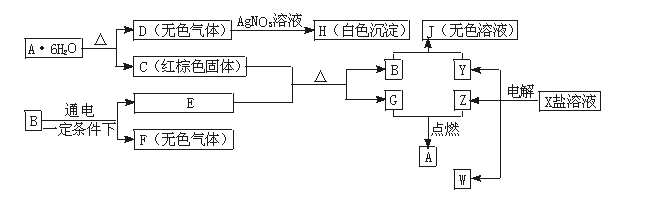
(1)F、H的化学式分别是_________________________ 、 _______________________。
(2)C+E反应的化学方程式是______________________________________ 。该反应的用途之一是 。
(3)写出A·6H2O转变为C和D的化学方程式____________________________。
(4)写出电解X溶液的离子方程式_____________________________。
(5)写出B和Y溶液反应生成J的化学方程式_________________________________
查看答案和解析>>
科目: 来源: 题型:
将54.4 g铁粉和氧化铁的混合物中加入200 mL的稀硫酸,恰好完全反应,放出氢气4.48 L(标准状况).反应后的溶液中滴加KSCN不显红色,且无固体剩余物,求:
①混合物铁和氧化铁各是多少克?②原稀硫酸物质的量浓度?③反应后得到FeSO4的物质的量是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com