
科目: 来源: 题型:
宇航员在升空、返回或遇到紧急情况时,必须穿上10公斤重的舱内航天服,神六宇航员所穿舱内航天服是我国科学家近年来研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,下列相关叙述错误的是w.w.w.k.s.5.u.c.o.m
A.它耐高温,抗氧化 B.它比钢铁轻、硬,但质地较脆
C.它没有固定熔点 D.它是一种新型无机非金属材料
查看答案和解析>>
科目: 来源: 题型:
(8分)有科学家提出硅是“21世纪的能源”、“未来的石油”,硅单质及其化合物应用范围很广,制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
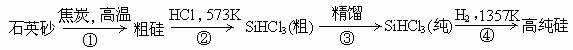
请回答下列问题:
(1)写出第①步的化学反应方程式___________________________;
(2)下列有关硅材料的说法正确的是________________(填字母):
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.硅可做“未来的石油”,可能的原因之一是燃烧放出的热量多,且燃烧产物对环境污染程度低,容易有效控制
C.普通玻璃是由烧碱、石灰石和石英砂制成的,其熔点很高
D.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
E.高纯度硅可直接用于制造高性能通讯材料——光导纤维
F. 氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
(3)SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式_______________________________________;
(4)单质硅遇到氢氧化钠溶液会完全溶解得到无色溶液并放出无色气体,请写出该反应的离子方程式________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(12分)不同的金属在化学反应中表现出来的活泼程度不同,俄国化学家贝开托夫在大量实验和系统研究之后,于1865年发表了金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 。
(1)金属活动性顺序是学习“金属及其化合物”的重要工具,许多“金属及其化合物”的知识规律可以通过金属活动性顺序来掌握。例如,工业上冶炼金属,根据金属活动性顺序可以采用不同的冶炼方法。其中可以用“热分解法”冶炼的金属是__________、 。
工业上又常用下列反应进行金属钾的冶炼:![]() ,似乎“违背”了金属活动性顺序,试解释钠能将更活泼的钾置换出来的原因__________________________ 。
,似乎“违背”了金属活动性顺序,试解释钠能将更活泼的钾置换出来的原因__________________________ 。
(2)在实践中发现还有许多化学事实 “违背”金属活动性顺序,但这些“反常”现象都可以通过化学原理得到合理解释。某学生在做探究实验时,把锌粒投入1mol·L-1氯化铁溶液中,观察到如下实验现象:锌粒表面有一定量气泡产生,溶液颜色逐渐变浅,一段时间后溶液逐渐浑浊,试用相关反应方程式进行解释_________________________________、
__________________________________________________________________________。
(3)研究金属活动性顺序还可以指导对金属阳离子氧化性强弱的认识,工业上用氯化铁溶液腐蚀铜制电路板。
①请根据金属活动性顺序结合该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性强弱 。
②请运用原电池原理设计实验验证Cu2+、Fe3+氧化性强弱的结论。
方案______________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(10分)某校化学兴趣小组设计了图示实验装置Ⅰ(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。试填空。
 |
(1)往铁碳合金中加入浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:
① 常温下碳与浓硫酸不反应;② ▲ 。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式 ▲ 。
(3)B中的现象是: ▲ ;C的作用是: ▲ 。
(4)甲同学认为利用装置Ⅰ测得铁的质量分数偏大,请你写出可能的原因:
▲ 。
(5)乙同学认为用装置Ⅰ操作较繁杂,于是他设计了图示装置Ⅱ,若再使用其它仪器可测得如下数据:
① 反应前后干燥管质量差a g ② 反应前后装置和药品的总质量之差b g
③ 用排水法得H2的体积V L ④ 反应后过滤、洗涤、干燥得残渣质量c g
试选用上述数据,以简便和精确地测算铁的质量分数,其代数式为 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
(6分)已知X为FeO和CuO的混合物,取两份等质量的X样品进行下列实验:
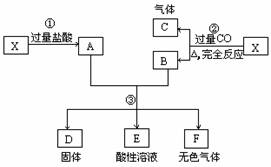 (1)写出③步所有反应的化学方程式;
(1)写出③步所有反应的化学方程式;
(2)设从③步所得固体D的质量为32 g,溶液E中只含有一种金属离子,气体F在标准状况下体积为5.6 L,试计算取用的每份X中FeO与CuO的质量比。
查看答案和解析>>
科目: 来源: 题型:
某工厂的废渣中混有少量的锌粉和氧化铜(其他成分不跟酸反应),跟大量废盐酸接触形成污水,产生公害。若向污水中撒入铁粉且反应后铁粉有剩余,此时污水中一定含有的主要阳离子是
A. Fe2+、Cu2+ B. Cu2+ 、 H+ C. Zn2+ 、Fe2+ D. Zn2+ 、Cu2+、H+
查看答案和解析>>
科目: 来源: 题型:
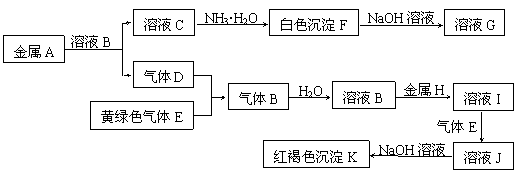 (5分)物质A、B、C、D、E、F、G、H、I、J、K有下图转化关系,其中气体D、E为单质,试回答:
(5分)物质A、B、C、D、E、F、G、H、I、J、K有下图转化关系,其中气体D、E为单质,试回答:
⑴ 组成金属A的元素在周期表的位置是_____________,D的化学式是__________________
⑵ 写出反应“C→F”的离子方程式 ;
⑶ 写出反应“F→G”的化学方程式 ;
⑷ 在溶液I中滴入NaOH溶液,可观察到的现象是 。
查看答案和解析>>
科目: 来源: 题型:
(6分)已知A、B、C是三种常见的单质,其中A为日常生活中常见的金属,B、C为气体;D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色;B和C反应的产物极易溶于水得无色溶液E。它们之间转化关系如图所示。


(1)写出下列物质的化学式:
B C
(2)写出D和E分别与A反应的离子方程式:
D+A:
E+A:
查看答案和解析>>
科目: 来源: 题型:
(10分)Cu—Fe合金由于长时间置于空气中表面产生了一层氧化膜(成分为Fe2O3和CuO),一化学研究性学习小组对其进行如下探究,请按要求完成下列探究报告。
探究目的:实验测定样品中Fe,Cu的质量。
探究思路:设计实验测量有关反应物和生成物的量,并通过计算确定样品中Fe,Cu的质量。
实验探究:(本实验中的气体体积均已换算成标准状况)
① 将此合金5.76g置于烧杯中,然后将稀H2SO4逐渐缓慢加入至过量,收集产生的气体测得其体积为VmL。过滤得浅绿色溶液A(不含Cu2+),还有滤渣B。
② 将滤渣B投入到一定浓度的HNO3中,完全溶解,收集产生的气体,经分析气体是NO和NO2的混合气体,总体积896mL,其中NO2体积为224mL。
③ 将①中所得的滤液加入到足量的同浓度HNO3中,充分反应后再加入足量的NaOH溶液,将产生的沉淀全部滤出,充分加热灼烧得红棕色固体,称量该固体的质量为3.2g。
结果处理:
(1) A中存在的阳离子有 ,滤渣B为 。
(2) 被腐蚀前的合金中Fe的质量为 g,Cu的质量为 g。
(3) 实验探究①中V为 mL (本小题需写出计算过程,可以直接利用(2)小题计算结果)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com