
科目: 来源: 题型:
向含 l mol HCl和l mol MgSO4的混合溶液中加入1 mol/L Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是
 |
查看答案和解析>>
科目: 来源: 题型:
有8.3g镁和铝的混合粉末溶于4mol/L的盐酸750mL中。若加入2mol /L的氢氧化钠溶液,要使产生的沉淀的质量最大,则需加入的氢氧化钠溶液的体积为
A.100mL B.500mL C.1000mL D.1500mL
查看答案和解析>>
科目: 来源: 题型:
向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL4 mol·L-1的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
A.0.21mol B.0.25mol C.0.3mol D.0.35mol
查看答案和解析>>
科目: 来源: 题型:
下列叙述中不正确的是
A.通过化合反应与置换反应均可以制得Fe3O4
B.通过化合反应与复分解反应均可以制得Fe(OH)3、NaHCO3
C.离子化合物的熔点不一定比共价化合物的熔点高
D.向含有1mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总物质的量为3 mol
查看答案和解析>>
科目: 来源: 题型:
已知,Fe2+结合S2-的能力大于结合OH-的能力,而Al3+则正好相反。在Fe2(SO4)3和AlCl3的混合溶
液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是
A.Al2S3、FeS和S B.Fe(OH)3和Al(OH)3
C.Fe2S3和 Al(OH)3 D.FeS、Al(OH)3和S
查看答案和解析>>
科目: 来源: 题型:
(10分)“烂板液”是制印刷锌板时,用稀HNO3腐蚀锌板后得到的废液,主要含Zn(NO3)2和由自来水带进的Cl-、Fe3+等杂质离子。在实验室中由“烂板液”制取ZnSO4·7H2O的过程如下:
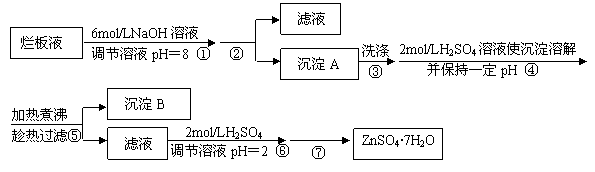 |
已知有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Zn2+ | 6.4 | 8.0 |
⑴沉淀B的主要成分是 。
⑵第②步操作中需要的玻璃仪器有 。
⑶第④步中pH应保持在 范围内。
⑷第⑥步调节溶液pH=2的目的是 。
⑸操作⑦包含3个基本实验操作,它们是蒸发浓缩、 和过滤。
查看答案和解析>>
科目: 来源: 题型:
(12分)某兴趣小组对如何延长硫酸亚铁溶液的保质期展开了研究。
⑴制备硫酸亚铁溶液,最合适的试剂组为 (填编号);
a.过量铁屑和稀硫酸 b.过量稀硫酸和铁屑 c.过量硫酸铁溶液和铁屑
⑵实验室保存硫酸亚铁溶液的一般方法是_____________________________________;
该兴趣小组取等体积的硫酸亚铁溶液分别加入三个烧杯中,各滴入3 滴KSCN试剂,然后进行如下实验:
| 烧杯编号 | ① | ② | ③ |
| 加入试剂 | 铁粉0.1g | 铁粉0.1g,0.1mol/LH2SO43mL | 0.1mol/LH2SO43mL |
| 红色出现时间(天) | 1天 | 4天左右 | 8天以上 |
⑶在烧杯②中加入2种试剂后,即可观察到的现象为 ;
⑷通过比较上述3组实验,可以得出的结论为 ;
⑸硫酸亚铁溶液在空气中易氧化,氧化产物易水解生成Fe(OH)3,导致溶液酸性增大。
试用一个离子方程式表示上述反应过程中的变化 ;
②硫酸亚铁溶液在空气中变质的反应为可逆反应,试用化学平衡理论解释烧杯③出现红色最晚的原因 。
查看答案和解析>>
科目: 来源: 题型:
下列操作中,溶液的颜色不发生变化的是 ( )
A.氯化铁溶液中加入还原性铁粉
B.硫酸铁溶液中滴加硫氰化钾溶液
C.碘水中滴加淀粉碘化钾溶液
D.碳酸氢钠溶液中滴加稀盐酸
查看答案和解析>>
科目: 来源: 题型:
将Na2O2、HCl和Al2O3起溶于一定量的水中,完全反应后测得所得溶液中只含有Na+、AlO2一、Cl一 (不考虑AlO2一的水解和H2O的电离),则Na2O2、HCl、Al2O3的物质的量之比不可能是 ( )
A.2∶2∶1 B.3∶3∶1 C.3∶4∶1 D.4∶6∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com