
科目: 来源: 题型:
下列离子方程式中,正确的是
A.在氯化铝溶液中加入过量氨水:Al3+ + 3OH- = Al(OH)3↓
B.在硝酸银溶液中滴入氯化钠溶液:Ag+ + Cl- = AgCl↓
C.金属钠与水反应: Na + 2H2O = Na+ + 2OH - + H2↑
D.铁与稀盐酸反应: 2Fe + 6H+ = 2Fe3+ + 3H2↑
查看答案和解析>>
科目: 来源: 题型:
无色透明溶液中放入铝片,产生大量氢气,该溶液中肯定可以大量存在的离子是
A.Fe2+、K+、Cl-、NO3- B.Na+、K+、CO32-、Cl-
C.Na+、Al3+、NO3-、SO42- D.K+、Na+、Cl-、Br-
查看答案和解析>>
科目: 来源: 题型:
(10分)实
验室用共沉淀法制备纳米级Fe3O4的流程如下:

该方法的关键为促进晶粒形成,并控制晶体生长。试回答下列问题:
(1)该反应原理的离子方程式可表示为 ▲ 。
(2)反应温度需控制在50℃,其方法是 ▲ ,温度偏低造成产量低的可能是 ▲ 。
(3)在搅拌Ⅱ的过程中还需加入10 mL正丙醇,其作用是 ▲ 。
(4)黑色糊状物转移至烧杯中,用倾析法洗涤,检验洗净的操作是 ▲ 。
(5)由上述分析可知,影响纳米级Fe3O4粒径大小的因素有(写出一条) ▲ 。
查看答案和解析>>
科目: 来源: 题型:
(10分)
锂被誉为“高能金属”。工业上用硫酸与β-锂辉矿(LiAlSi2O6和少量钙镁杂质)在250~300℃反应,生成Li2SO4以及硅铝化合物、MgSO4等,其工业生产流程如下:

(1)用氧化物形式表示LiAlSi2O6的组成:___________________。
(2)沉淀X的主要成分是(写化学式)________________________。
(3)流程中两次使用了Na2CO3溶液,试说明前后浓度不同的原因:
____________________________________________________________________。
(4)锂和氢气在加热时能反应生成白色固体氢化锂,氢化锂遇到水就立即溶解并释放出大量的气体。试写出氢化锂遇水反应的化学方程式:_______________________________________。
(5)将盐酸与Li2C03完全反应后的溶液,加热蒸干得到固体,再将其熔融电解生产锂。电解时产生的氯气中会混有少量氧气,原因是____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(6分)某化学学习小组用如图所示装置研究不同条件下铁与硝酸反应的情况。其实验
 步骤如下:
步骤如下:
①在大试管中先加入一小块铁(过量),再加入一定量的浓硝酸;
②用仪器a再加入适量的水;
③反应结束后取少量上层溶液于另一试管中,滴加几滴KSCN溶液;
④再用仪器a向③的试管中滴加适量的稀盐酸。
请回答下列问题:
(1)仪器a的名称是 。
(2)步骤①无明显现象,原因是 。
(3)步骤④的主要现象是 ,有关反应的离子方程式是 。
(4)学习小组在进行实验后发现该实验装置存在着一种明显的缺陷,请给出一种简单
的消除此缺陷的措施: 。
查看答案和解析>>
科目: 来源: 题型:
 |
(1) 用98%的硫酸配制28%的稀硫酸,所需的玻璃仪器除量筒外,还有 ▲ 。
A. 玻璃棒 B. 烧杯 C. 烧瓶 D. 容量瓶
(2)配平以下离子方程式:
▲ Fe2+ + ▲ ClO3― + ▲ H+ = ▲ Fe3+ + ▲ Cl― + ▲
(3)聚合硫酸铁溶液中SO42―与Fe3+物质的量之比不是3∶2。为了测定聚合硫酸铁中SO42―与Fe3+物质的量之比,应选择的试剂是 ▲ (填序号)。
A. NaOH B. FeSO4 C. BaCl2 D. NaClO3
实验时需要测定的量是Fe2O3和 ▲ 的质量(填写化合物的化学式)。
查看答案和解析>>
科目: 来源: 题型:
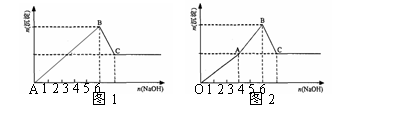 Mg2+和Al3+的混和溶液中逐滴加入NaOH溶液,形成沉淀的情况出现两种图示。图1为小杨同学绘制,图2是小周根据实验结果绘制,查阅沉淀生成和Al(OH)3溶解的pH情况如表。下列说法正确的是
Mg2+和Al3+的混和溶液中逐滴加入NaOH溶液,形成沉淀的情况出现两种图示。图1为小杨同学绘制,图2是小周根据实验结果绘制,查阅沉淀生成和Al(OH)3溶解的pH情况如表。下列说法正确的是
 A. 据图计算得n(Mg2+): n(Al3+)=2:1
A. 据图计算得n(Mg2+): n(Al3+)=2:1
B. 小周实验中,OA段生成两种沉淀
C. 图2中OA段表示仅生成Al(OH)3沉淀,AB段仅生成 Mg(OH)2
D. 结合表中数据和图2分析,AB段可能发生:Mg2++2AlO2—+4H2O =2Al(OH)3↓+Mg(OH)2↓
查看答案和解析>>
科目: 来源: 题型:
(8分)坐落在山东沿海地区的潍坊纯碱厂是我国重点大型企业,其生产工艺沿用我国化学侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
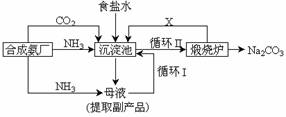
①上述生产纯碱的方法称 ,副产品的一种用途为 。
②沉淀池中发生的化学反应方程式是 。
③写出上述流程中X物质的分子式 。
④使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。
⑤向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
查看答案和解析>>
科目: 来源: 题型:
下列操作中,溶液的颜色不发生变化的是
A.氯化铁溶液中加入还原性铁粉 B.硫酸铁溶液中滴加硫氰化钾溶液
C.碘水中滴加淀粉碘化钾溶液 D. 碳酸氢钠溶液中滴加稀盐酸
查看答案和解析>>
科目: 来源: 题型:
将Na2O2、HCl和Al2O3起溶于一定量的水中,完全反应后测得所得溶液中只含有Na+、AlO2一、Cl一 (不考虑AlO2一的水解和H2O的电离),则Na2O2、HCl、Al2O3的物质的量之比不可能是
A.2∶2∶1 B.3∶3∶1 C.3∶4∶1 D.4∶6∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com