
科目: 来源: 题型:
(5分)据报道,2005年3月29日晚6时许,京沪高速淮安段,一辆由山东开往上海方向的槽罐车与一辆迎面驶来的解放牌大货车相撞后翻倒在地,槽罐车上满载的约32吨液态氯气快速泄漏。泄露出的氯气迅速向周围的村庄蔓延,所到之处草木枯黄、大片作物被毁。中毒死亡者达28人,另有350多人入院治疗。请回答下列问题:
(1)如果你当时在现场,你应该往哪里撤离?(山坡上/低洼处)
(2)如果你当时在距离出事地点较近的学校或家中,如何利用一些现成物质来制作简易的“防毒面具”?
(3)消防官兵赶到现场处理,他们先把泄漏的氯气钢瓶投入一盛有某物质水溶液的水缸中,该物质为_______,其中发生反应的化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:
请利用下列装置及试剂组装一套装置。其流程是,先制取纯净干燥的Cl2(不
收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。

(1)按气体从左向右流向将各装置依次连接起来(填接口标号):
a 接 , 接 , 接 , 接 , 接 。
(2)B中发生反应的化学方程式是 。
(3)D装置的作用是 ,E装置的作用是 ,F装置的作用是 。
(4)C瓶中的现象是 ,B瓶中的现象是 。以上事实说明起漂白作用的物质是 。
查看答案和解析>>
科目: 来源: 题型:
已知实验室制氯气的化学方程式为:MnO2 + 4HCl (浓) = MnCl2 + Cl2↑+ 2H2O,现用足量浓盐酸在加热条件下跟二氧化锰反应制取氯气。若标准状况下制得Cl22.24L求:
(1)二氧化锰的质量;
(2)把(1)中反应后的溶液稀释到50 mL,从中取出10.0 mL,加入10.0 mL 0.600 mol / L的硝酸银溶液,恰好将氯离子完全沉淀。求(1)中反应后溶液稀释到50 mL时氯离子的物质的量浓度是多少?
查看答案和解析>>
科目: 来源: 题型:
(5分)钛(Ti )被称
为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。
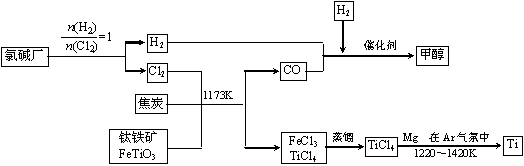
在上述产业链中,合成96 t甲醇理论上需额外补充H2 t (不考虑生产过程中物质的任何损失,要写出计算过程)。
选做题(本题分A、B两题,考生只要选择其中一题作答。若两题都作答,则以A题得分计入总分。本题共12分)
查看答案和解析>>
科目: 来源: 题型:
| 无内容 |
查看答案和解析>>
科目: 来源: 题型:
(8分)
为了探究铁与氯气在一定条件下反应后的固体中铁元素的价态,化学兴趣小组的甲、乙、丙三同学分别进行了如下实验。
(1)甲取少许反应后的固体,加入适量稀硝酸,在所得溶液中滴加KSCN溶液出现血红色,则此时溶液显血红色的离子方程式为_________________________________________________。该同学由此得出铁与氯气的反应产物中含有+3价铁的结论。请指出该结论是否合理并说明理由_________________________________________________________。
(2)乙取少许反应后的固体,加入盐酸,溶解、过滤,向滤液中滴加KSCN溶液,溶液呈无色。乙由此得出铁与氯气的反应产物中含有+2价铁的结论。请指出该结论是否合理并说明理由
_____________________________________________________________________________。
(3)丙取11.2g铁粉与氯气反应,将反应后所得固体研碎分成两等份,其中一份用磁铁吸引,吸出的固体质量为1.4g;另一份用水完全溶解后加入足量的硝酸银溶液,所得白色沉淀经洗涤干燥后称重为32.29g。根据以上数据确定反应产物中铁元素的价态是____________(写出计算和推理过程)。
查看答案和解析>>
科目: 来源: 题型:
(10分)氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制
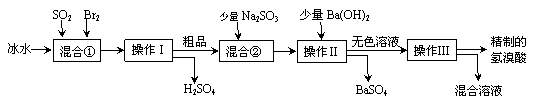 的流程:
的流程:
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为 。
(2)混合①中使用冰水的目的是 。
(3)操作Ⅱ和操作Ⅲ的名称分别是 、 。
(4)混合②中加入Na2SO3的目的是 。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为 ,若假设成立可观察到的现象为 。
乙同学假设工业氢溴酸呈淡黄色是因为_______,其用于证明该假设所用的试剂为 。
查看答案和解析>>
科目: 来源: 题型:
(10分)制取碘盐的流程如下:

试回答下列问题
(1)检验母液中是否含有SO42-离子的方法是 ▲ 。
(2)过滤时,用到的玻璃仪器有: ▲ 、 ▲ 、 ▲ 。
(3)国家标准GB546061-92规定碘盐含碘量(以碘计),出厂产品≥40mg/Kg。销售品≥30mg/Kg。某次实验时向一干净的坩埚中放入5g精盐,加入1mL0.001mol/L标准KIO3溶液搅拌均匀,在100℃恒温烘干1h,即得碘盐产品,该碘盐的含碘量约为: ▲ mg/Kg(保留一位小数),是否是合格产品 ▲ (填:合格、不合格)。
(4)检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6IO3-+5CNS-+H++2H2O=3I2+5HCN+5SO42-,检验时,除需用KCNS外,还需要的一种试剂,最好是 ▲ 。
(5)碘盐中的碘酸钾在560℃开始分解产生无色气体,剩余固体加硝酸酸化的硝酸银有黄色沉淀,碘盐在热水中,也会生成两种单质,其中一种是无色气体,滴加酚酞显红色,请写出碘酸钾两种情况下分解的化学方程式: ▲ 或 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
(11分)某学生利用以下装置探究喷泉实验。其中A、F分别为硫化氢和氯气的发生装置,C为纯净干燥的氯气与硫化氢反应的装置。
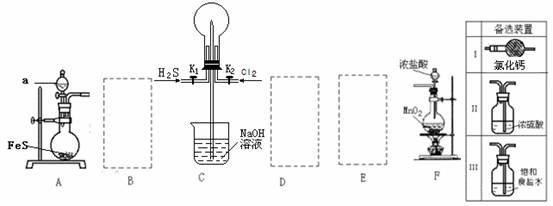
请回答下列问题:
(1)装置F中发生反应的化学方程式 。
(2)装置A中的分液漏斗内液体a宜选用 (选填以下选项的代号)
A.盐酸 B.浓硫酸 C.稀硫酸 D.稀硝酸
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择。并将编号填入下列空格。
B__________、D__________、E__________(填编号)
(4)打开K1、K2,将常温压下的H2S、Cl2以体积比1:1充满烧瓶后,再关闭K1、K2,始终看不到烧瓶内产生“喷泉”现象,理由(用简要文字并配备化学方程式描述): 。
(5)在操作(4)的基础上,引发喷泉操作方法是 。
查看答案和解析>>
科目: 来源: 题型:
NA表示阿伏加德罗常数的值,下列说法中正确的是
A.常温常压下,21g氧气和27g臭氧所含氧原子总数为3NA
B.34 g H2O2中含阴离子数为NA
C.饱和FeCl3溶液加入沸水中,若有1mol FeCl3水解,可生成NA个胶体粒子
D.80mL 10mol/L浓盐酸与足量MnO2加热反应,转移电子数为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com