
科目: 来源: 题型:
六氟化硫分子为正八面体构型(分子结构如图所示),难溶于水,在 高温下仍有良好的绝缘性,在电器工业方面具有广泛用途。下列推测正确的是
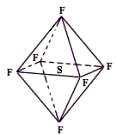 A.SF6中各原子均达到8电子稳定结构
A.SF6中各原子均达到8电子稳定结构
B.SF6易燃烧生成SO2
C.SF6分子是含有极性键的非极性分子
D.SF6的一氯代物只有一种
查看答案和解析>>
科目: 来源: 题型:
现代无机化学对硫—氮化合物的研究是最为活跃的领域之一。其中右图所示是已合成的最著名的硫—氮化合物的分子结构。下列说法正确的是 ( )
A.该物质的分子式为SN
B.该物质的分子中既有极性键,又有非极性键
C.该物质在固态时形成原子晶体
D.该物质与化合物S2N2互为同素异形体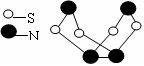
查看答案和解析>>
科目: 来源: 题型:
(12分)
已知LiH、NaH及LiAlH4都是常见的金属的氢化物,其中LiAlH4可由下列途径合
成: 4LiH + AlCl3 ![]() LiAlH4+ 3LiCl。
LiAlH4+ 3LiCl。
试探究下列相关问题
(1)下列有关说法正确的是 ▲ 。
A.该反应是氧化还原反应
B.乙醚(C2H5OC2H5)是非极性分子
C.化学性质锂与镁相似,铝与铍相似
D.LiAlH4具有还原性
(2)正在载入...
镧镍合金、铜钙合金及铈钴合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力,其中铜钙合金的晶胞结构为:
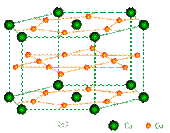
试回答下列问题
①在周期表中Ca处于周期表 ▲ 区。
②铜原子的基态核外电子排布式为: ▲ 。
③已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5的合金(氢进入晶胞空隙,体积不变),则LaNin中,n= ▲ (填数值);氢在合金中的密度为: ▲ 。
(3)中美科学家合作发现钙和锶在C60上吸附很强,可以均匀地覆盖在C60表面上,形成M32C60。非常适于实际应用。 Ca32C60上可吸附至少92个氢分子(如图)。

有关说法正确的是 ▲ 。
A.钙的第一电离能和电负性均比锶的第一电离能小
B.C60中碳原子杂化方式为sp3
C.Ca32C60储氢是与H2发生加成反应
D.吸附相同数目氢分子时, 储氢质量分数(wt%。)Ca32C60 比Sr32C60高
查看答案和解析>>
科目: 来源: 题型:
砷化镓(GaAs)属于第三代半导体,用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。砷化镓的晶胞结构如右图。试回答:
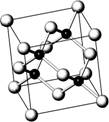 (1)As的核外电子排布式为 。
(1)As的核外电子排布式为 。
(2)砷化镓晶胞中所包含的Ga原子个数为 。
(3)下列说法正确的是 (填字母)。
A.砷化镓晶胞结构与NaCl相同
B.第一电离能:As>Ga
C.电负性:As>Ga
D.砷化镓晶体中含有配位键
E.半导体GaP与GaAs互为等电子体
(4)砷化镓是将(CH3)3Ga和AsH3用MOCVD方法在700℃时制备得到。AsH3的空间形状为 ,(CH3)3Ga中镓原子的杂化方式为 。
(5)AsH3沸点比NH3低,其主要原因是 。
查看答案和解析>>
科目: 来源: 题型:
下列有关
试验操作的叙述正确的是
 A.用相互滴加的方法鉴别Ba(OH)2和NaHCO3两溶液
A.用相互滴加的方法鉴别Ba(OH)2和NaHCO3两溶液
B.用硫酸溶液洗涤并灼烧铂丝后,再进行焰色反应
C.除去KCl中混有的BaCl2,可用Na2CO3溶液、盐酸
D.1—丁醇和乙酸在浓硫酸作用下,W#W$W%.K**S*&5^U用如图装置可制得乙酸丁酯
查看答案和解析>>
科目: 来源: 题型:
(10分)钨是高熔点金属,工业上用黑钨铁矿[(Fe,Mn)WO4]冶炼金属钨有多种方法,同时还可制得副产品高锰酸钾。已知WO3是钨的稳定氧化物,它不溶于水也不溶于酸,可用钨酸(H2WO4,黄色,不溶于水)或某些钨酸盐分解制得。其主要的工艺流程如下:

请根据图示及所学知识回答下列问题:
(1)写出反应④的化学方程式: ▲ 。
(2)写出反应⑨的离子方程式: ▲ 。
(3)方法二制WO3的过程中,需洗涤CaWO4,如何检验CaWO4已洗涤干净: ▲ 。
(4)整个工艺流程所涉及的物质中,属于酸性氧化物的有 ▲ 。
(5)写出反应⑩中阳极反应的电极反应式: ▲ 。
查看答案和解析>>
科目: 来源: 题型:
进行化学实验,观测实验现象,通过分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是 ( )
A.在某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,说明溶液中含有SO42-
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口,说明此位置指示的是被蒸馏出物质的沸点。
C..溴水中通入SO2后,颜色褪去,说明SO2表现了漂白性
D.浓硝酸在光照条件下变黄,说明浓硝酸不稳定生成有色产物能溶于浓硝酸
查看答案和解析>>
科目: 来源: 题型:
(10分)某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为两者反应生成只有CuCO3一种沉淀;
乙同学认为这两者相互促进水解反应,生成Cu(OH)2一种沉淀;
丙同学认为生成CuCO3和Cu(OH)2两种沉淀。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照乙同学得理解Na2CO3溶液和CuSO4溶液反应的化学反应方程式为 ;
在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为①过滤②洗涤③干燥。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。

![]()
![]() (1)各装置连接顺序为 。
(1)各装置连接顺序为 。
(2)装置C中装有试剂的名称是 。
(3)能证明生成物中有CuCO3的实验现象是 。
Ⅲ.若CuCO3和Cu(OH)2两者都有,可通过下列所示装置进行定量分析来测定其组成。
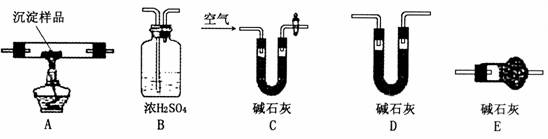
(1)装置C中碱石灰的作用是 ,实验开始时和实验结束时都要通入过量的空气其作用分别是 (2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为
。
查看答案和解析>>
科目: 来源: 题型:
(9分)氢氧化镁用于制药工业,还是重要的绿色阻燃剂。
I、治疗胃酸过多药物Stmoache的有效成分为Mg(OH)2。
(1)该药物治疗胃酸(主要成分为盐酸)过多症时反应的离子方程式:____________________________________________。
Ⅱ、已知:Mg (s)+2H2O(g)=Mg(OH)2(s)+H2(g) △H1=-441kJ·mol-1
H2O(g)=H2(g)+![]() O2(g) △H2=+242kJ·mol-1
O2(g) △H2=+242kJ·mol-1
Mg(s)+![]() O2(g)=MgO(s) △H3=-602kJ·mol-1
O2(g)=MgO(s) △H3=-602kJ·mol-1
(2)氢氧化镁分解的热化学方程式是_______________________________________。
(3)氢氧化镁可以作为阻燃剂的原因____________________。(写一条即可)
Ⅲ、某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制,获得阻燃剂氢氧化镁。
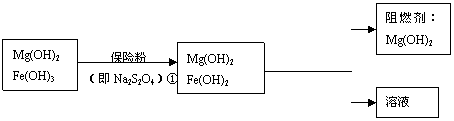

(4)步骤②中分离操作的名称是_____________。
(5)步骤①中的反应如下:6Fe(OH)3 +S2O42-+2OH- =6Fe(OH)2 +2SO42-+4H2O。
每消耗0.1mol保险粉(Na2S2O4)时,转移电子的数目是 NA。
(6)已知EDTA只能与溶液中的Fe2+反应生成易溶于水的物质,不与Mg(0H)2反应。虽然Fe(OH)2难溶于水,但步骤②中随着EDTA的加入,最终能够将Fe(OH)2除去并获得纯度高的Mg(OH)2。请从沉淀溶解平衡的角度加以解释。
答:___________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com