
科目: 来源: 题型:
(10分)已知氯化铝的熔点为190℃(2.02×105Pa),但它在180℃即开始升华。
(1)氯化铝是 (填“离子化合物”或“共价化合物”)
![]() (2)在500K和1.01×105Pa时,它的蒸气密度(换算为标准状况)为11.92g/L,且已知它的结构中有配位键,氯化铝的化学式为 ,结构式为 。
(2)在500K和1.01×105Pa时,它的蒸气密度(换算为标准状况)为11.92g/L,且已知它的结构中有配位键,氯化铝的化学式为 ,结构式为 。
(3)无水氯化铝在空气中强烈的“发烟”,其原因是 。
(4)设计一个更可靠的实验,判别氯化铝是离子化合物还是共价化合物。你的设计是:
。
查看答案和解析>>
科目: 来源: 题型:
最近媒体报道了一些化学物质,如:爆炸力极强的N5、结构类似白磷的N4、比黄金还贵的18O2、太空中的甲醇气团等。下列说法正确的是
A.![]() 是化学变化
是化学变化
B.N4分子为正方形结构,每个分子中含有6个共价键
C.18O2和16O2互为同分异构体
D.甲醇的结构式为:CH3OH
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.第二周期元素的第一电离能随原子序数递增依次增大
B.卤族元素中氟的电负性最大
C.CO2、SO2都是直线型的非极性分子
D.CH2=CH2分子中共有四个![]() 键和一个
键和一个![]() 键
键
查看答案和解析>>
科目: 来源: 题型:
下列叙述中,结论(事实)和对应的解释(事实)均不正确的是
A.金刚石的熔沸点高于晶体硅,因为C一C键能大于Si一Si键能
B.稀有气体的晶体属于原子晶体,因为其构成粒子间作用力为共价键
C.NH4+ 与Cu2+ 间不能形成配位键,因为NH4+ 中N 原子不存在孤对电子
D.p轨道之间只能形成π键,因为p轨道与p轨道之间只能以“肩并肩”方式重叠
查看答案和解析>>
科目: 来源: 题型:
(12分)下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
 (2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的
体心、顶点、面心),则该化合物的化学式为
(用对应的元素符号表示)。
(3)元素②的一种氢化物是重要的化工原料,
常把该氢化物的产量作为衡量石油化工发展水
平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该氢化物分子中,②原子采用sp2杂化
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。
(5)A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
(6)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+ 颜色(填“无”或“有”)。
查看答案和解析>>
科目: 来源: 题型:
![]() 已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体的说法错误的是
已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体的说法错误的是
A. 该晶体属于原子晶体,其化学键比金刚石更牢固
B.该晶体中每个碳原子上连有4个氮原子、每个氮原子上连有三个碳原子
C.该晶体中碳原子和氮原子都满足最外层8电子结构
D.该晶体与金刚石类似,都是原子间以非极性键形成空间网状结构
查看答案和解析>>
科目: 来源: 题型:
 晶胞是构成晶体的基本重复单元。在二氧化硅晶胞中有8个硅原子位于立方晶胞的8个顶角,有6个硅原子位于晶胞的6个面心,还有4个硅原子与16个氧原子在晶胞内构成4个硅氧四面体,它们均匀错开排列于晶胞内。根据图示二氧化硅晶胞结构,每个晶胞内所含“SiO2”基元数为 :
晶胞是构成晶体的基本重复单元。在二氧化硅晶胞中有8个硅原子位于立方晶胞的8个顶角,有6个硅原子位于晶胞的6个面心,还有4个硅原子与16个氧原子在晶胞内构成4个硅氧四面体,它们均匀错开排列于晶胞内。根据图示二氧化硅晶胞结构,每个晶胞内所含“SiO2”基元数为 :
A.4个 B.6个 C.8个 D.18个
查看答案和解析>>
科目: 来源: 题型:
![]()
 六氟化硫分子为正八面体构型(分子结构如图所示),难溶于水,在高温下仍有良好的绝缘性,在电器工业方面具有广泛用途。下列推测正确的是:
六氟化硫分子为正八面体构型(分子结构如图所示),难溶于水,在高温下仍有良好的绝缘性,在电器工业方面具有广泛用途。下列推测正确的是:
A.SF6中各原子均达到8电子稳定结构
B.SF6易燃烧生成SO2
C.每摩尔SF6中含有6摩尔S-F键
D.SF6是分子晶体
查看答案和解析>>
科目: 来源: 题型:
二氧化硅晶体是空间网状结构,如右图所示。关于二氧化硅晶体
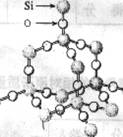 的下列说法中,不正确的是 ( )
的下列说法中,不正确的是 ( )
A.1 mol SiO2 晶体中Si—O键为2mol
B.晶体中Si、O原子个数比为1:2
C.晶体中Si、O原子最外电子层都满足8电子结构
D.晶体中最小环上的原子数为8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com