
科目: 来源: 题型:
设C+CO2![]() 2CO △H > 0的反应速率为 u 1;N2+3H2
2CO △H > 0的反应速率为 u 1;N2+3H2![]() 2NH3 △H < 0的反应速率为 u 2;
2NH3 △H < 0的反应速率为 u 2;
对于上述反应,当温度升高时,u 1和u 2的变化情况为
A.同时增大 B.同时减小 C.增大,减小 D.减小,增大
查看答案和解析>>
科目: 来源: 题型:
下列叙述中正确的是
A.常用50mL滴定管上的最小刻度是0.01mL
B.用小烧杯称取样品时,使用电子天平比托盘天平更方便、准确度更高,在读数时,电子天平的侧门可以不关闭
C.润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次
D.滴定过程中滴加溶液的速度不能太快,一般以每秒3~4滴为宜
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.活化分子之间的碰撞一定是有效碰撞
B.升高温度时,活化分子百分数增加
C.反应物分子的每次碰撞都能发生化学反应
D.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
查看答案和解析>>
科目: 来源: 题型:
下列说法不正确的是
A.pH=7的溶液不一定是中性溶液
B.能自发进行的化学反应,一定是△H<0、△S>0
C.自行车钢架生锈主要是电化学腐蚀所致
D.Zn 具有还原性和导电性,可用作锌锰干电池的负极材料
查看答案和解析>>
科目: 来源: 题型:
下列判断正确的是
①Ca(OH)2微溶于水,所以Ca(OH)2是弱电解质;②强电解质溶液的导电能力可能比弱电解质溶液导电能力弱;③液态氯化氢不导电,但它是电解质;④碳酸氢钠是弱酸的酸式盐,所以是弱电解质;⑤SO3溶于水后导电,所以SO3是电解质;⑥Cu能导电,但它不是化合物,所以Cu是非电解质
A.②③ B.②③⑥ C.①④⑤⑥ D.②③⑤
查看答案和解析>>
科目: 来源: 题型:
最近《科学》杂志评出10大科技突破,其中“火星上‘找’到水的影子”名列第一。下列关于水的说法中正确的是
A.水的电离过程是放热的过程 B.水的电离和电解都需要电
C.冰熔化成水是一个吸热的过程 D.加入电解质一定会破坏水的电离平衡
查看答案和解析>>
科目: 来源: 题型:阅读理解
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡; 试管B中产生的气泡量增大。 |
| ② | 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生。 |
(1)过氧化氢分解的化学方程式为 ▲ (1分)。
(2)实验①的目的是 ▲ (1分)。
实验中滴加FeCl3溶液的目的是 ▲ (1分)。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是 ▲ (2分)(用实验中所提供的几种试剂)。
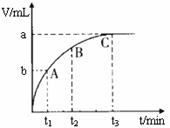
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,则A、B、C三点所表示的瞬时反应速率最慢的是 ▲ (1分)。
(5)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
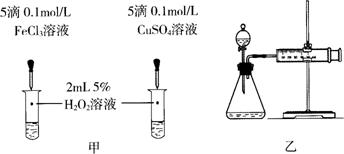
①定性分析:如图甲可通过观察 ▲ (1分),定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 ▲ (2分)。
②定量分析:用图乙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是 ▲ (2分)。
查看答案和解析>>
科目: 来源: 题型:
现准确称取0.92 g样品(只含C、H、O三种元素中的两种或三种),经完全燃烧后生成的CO21.76 g,生成的水1.08 g。
(1)则该有机物的元素组成为: ▲ (1分)
(2)若该有机物的摩尔质量为46g/mol;请写出该有机物各种可能的结构简式为:
▲ (2分)
(3)请设计简单实验证明该有机物是上述何种物质(备选试剂:NaOH溶液、石蕊试液、Na、冰醋酸、CaCO3 实验仪器自选)
▲ (2分)
查看答案和解析>>
科目: 来源: 题型:
下列是模拟石油深加工来合成CH2=CHCOOCH2CH3(丙烯酸乙酯) 等物质的过程:
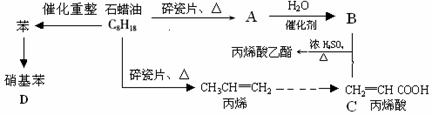
请回答下列问题:
(1)A结构简式为: ▲ (1分)
(2)CH2=CHCOOCH2CH3的含氧官能团 ▲ (填名称)(1分);
(3)写出下列反应方程式(各2分):
①B + C→CH2=CHCOOCH2CH3: ▲ ;
②丙烯→聚丙烯: ▲ ;
③苯→硝基苯: ▲ ,
(4)目前制备酒精的方法有两种:
![]() 方法一:
方法一:
![]() 方法二:
方法二:
①对方法一所涉及的反应类型分别为: ▲ (1分): ▲ (1分)
②对于方法二, M的结构简式为: ▲ (1分)
③下列说法正确的是_____▲_______(填代号) (1分)
A、从绿色化学的角度看方法一的原子利用率100%
B、从原料的可再生性来说,方法二最好
C、方法二产物乙醇储藏的化学能来自于太阳能
查看答案和解析>>
科目: 来源: 题型:
已知:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) 在容积固定的恒温密闭容器中充入NH3和O2发生上述反应,容器内部分物质的物质的量浓度如下表:
4NO(g)+6H2O(g) 在容积固定的恒温密闭容器中充入NH3和O2发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3)(mol/L) | c(O2 )(mol/L) | c(NO)(mol/L) |
| 起始 | 0.800 | 1.000 | 0.000 |
| 第2 min | a | b | c |
| 第4 min | 0.400 | 0. 500 |
(1)下列能说明该反应已经达到平衡状态的是 ▲ (1分) ;
A.容器中气体平均摩尔质量不变 B.c(O2)不变 C.v(O2)= 1.25v(NH3) D.体系气体无颜色变化 E.体系压强不变
(2) 在容器中加入正催化剂,则反应速率 ▲ (填“增大”“减小”“不变”;后同),降低容器的温度则反应速率 ▲ (各1分)。
(3)反应在第2 min时,容器中压强与反应前之比为19︰18则a= ▲ mol/L;0~2 min平均速率v(NH3)= ▲ 。第4 min时反应 ▲ (是、否)达到平衡(各1分)
(4)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小,其原因可能 ▲ (1分)。
(5)如果把该反应设计为原电池,NH3在原电池 ▲ 极,电解质溶液中阴离子向 ▲ 极移动(各1分)。若果以NaCl为电解质,正极反应为:
▲ (2分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com