
科目: 来源: 题型:阅读理解
现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高。
(1)已知1 mol N2(g)与适量H2(g)完全反应,当生成NH3(g)0.1mol时,放出9.22kJ热量,写出反应的热化学方程式: 。
(2)若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1 K2(填“>” “=” 或 “<” )。
(3)在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol H2 及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为 ,用氮气表示的反应速率: 。若想提高氨气的产率,根据化学平衡移动原理,请提出合理的建议: (任意写一条)。
(4)在上述相同条件下,若起始时加入4 mol NH3、2 mol H2及固体催化剂,反应达到平衡时NH3的体积分数比(3)中 (填“大”、“小”或“相等”)。
 (5)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如右图)。在电解法合成氨的电解池中 (填“能”或“不能”) 用水作电解质溶液的溶剂,原因是 。
(5)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如右图)。在电解法合成氨的电解池中 (填“能”或“不能”) 用水作电解质溶液的溶剂,原因是 。
钯电极A是电解池的 极(填“阳”或“阴”),
该极上的电极反应式是 。
查看答案和解析>>
科目: 来源: 题型:
按要求回答下列问题
(1)用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是 (填序号 )
①碱式滴定管用蒸馏水洗净后没有用标准液润洗 ②锥形瓶用蒸馏水洗净后没有用待测液润洗
③用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失 ⑤终点读数时俯视,其他读数方法正确
(2)某课外活动小组同学用右图甲装置进行实验,试答下列问题:
 ①若开始时开关K与a连接,则铁发生电化学腐蚀中的 腐蚀。
①若开始时开关K与a连接,则铁发生电化学腐蚀中的 腐蚀。
②若开始时开关K与b连接,则总反应的离子方程式为 。
(3)常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字):c(OH-)-c(HA)= ___________ mol/L。
(4)在Cl-、Al3+、HSO4-、K+、HS-五种离子中,只能水解不能电离的离子是 ,只能电离不能水解的离子是 ,既能电离又能水解的离子是 ,写出能水解离子的水解离子方程式 , 。
(5)已知25℃时,Mg(OH)2的溶度积常数Ksp = 5.6×10-12,测得某溶液的pH = 13,则此温度下溶液中的c(Mg2+) = ____________________。
查看答案和解析>>
科目: 来源: 题型:
某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处
理并没有NH3放出,则关于此化合物的说法中正确的是
A.配合物中中心原子的电荷数和配位数均为6 B.该配合物可能是平面正方形结构
C.Cl— 和NH3分子均与Pt4+配位 D.配合物中Cl— 与Pt4+配位,而NH3分子不配位
查看答案和解析>>
科目: 来源: 题型:
今有室温下四种溶液,有关叙述不正确的是
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va∶Vb=11∶9
查看答案和解析>>
科目: 来源: 题型:
下列热化学方程式中,正确的是
A.甲烷的燃烧热ΔH=- 890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: N2(g)+3 H2(g)![]()
![]() 2 NH3(g) ΔH = -38.6 kJ·mol-1
2 NH3(g) ΔH = -38.6 kJ·mol-1
C.HCl和NaOH反应的中和热ΔH= -57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2 H2(g)+O2(g)=2 H2O(l) ΔH= -571.6 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
目前,人们正在研究开发一种高能电池---钠硫电池,它是以熔融的钠和硫为两极,以Na+ 导电的β′—Al2O3陶瓷作固体电解质,反应式如下:Na2Sx![]() 2Na+xS,以下说法正确的是
2Na+xS,以下说法正确的是
A、放电时,Na 作正极,S极发生还原反应 B、充电时钠极与外电源的正极相连
C、当用该电池电解AgNO3溶液时,阳极上产生标准状况下气体11.2L时,消耗金属钠2.3g
D、充电时,阳极发生的反应为:Sx2--2e— = xS
查看答案和解析>>
科目: 来源: 题型:
下列说法中正确的是
A.乙烯中C=C的键能是乙烷中C-C的键能的2倍 B.氮气分子中含有1个s键和2个p键
C.N-O键的极性比C-O键的极性大 D.NH4+中4个N-H键的键能不相同
查看答案和解析>>
科目: 来源: 题型:
T°C时,将体积为VAL、浓度为a mol/L的一元酸HA与体积为VBL、浓度为b mol/L的一元碱BOH混合,混合液恰好呈中性,则下列判断正确的是
A.混合液的pH=7 B.a=b C.混合液中Kw=[c(H+)]2 D.a=b,VA=VB
查看答案和解析>>
科目: 来源: 题型:
在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
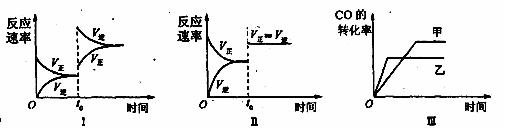
下列分析中不正确的是
A、图Ⅰ研究中的是t0时升高温度对反应速率的影响
B、图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C、图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D、图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com