
科目: 来源: 题型:
碘在科研与生活中有重要的应用。某兴趣小组用0.50mol·L-1 KI 、0.2%淀粉溶液 、0.20mol·L-1 K2S2O8 、0.10mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。已知S2O82—+2I—=2SO42—+I2 (慢) I2 +2S2O32—=2I—+S4O62—(快)
(1)向KI 、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8 溶液,当溶液中
(写离子符号)耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32—与S2O82—初始的物质的量需满足的关系为n(S2O32—)︰n(S2O82—) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验 序号 | 体积/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | VX | 4.0 | 4.0 | 2.0 |
表中VX= mL,理由是 。
查看答案和解析>>
科目: 来源: 题型:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛的应用。请回答下列问题:
(1)氨气可由N2和H2反应制取,N2(g)+3H2 (g) ![]() 2NH3(g)反应
2NH3(g)反应
过程的能量变化如图所示:
已知:1molN2分子中的化学键断裂时需要吸 
收942kJ的能量;1molH2分子中的化学键断
裂时需要吸收436kJ的能量;形成1mol N—H
键时释放390.8kJ的能量。
①图中A、C分别表示
,E的大小对该反应
的反应热有无影响? 。
该反应需要用铁触媒作催化剂,加铁触媒会使图中B点升高还是降低?
理由 。
②图中△H= kJ·mol-1。
③如果反应速率ν(H2)为0.15mol· L-1 ·min-1,则ν(N2)= mol· L-1 ·min-1 ν(NH3)= mol·L-1 ·min-1。
(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:N2(g)+2O2(g)=N2O4(l) △H= -19.5kJ·mol-1
N2H4(l)+O2(g)= N2(g)+2H2O(g) △H= -534.2kJ·mol-1
请写出肼和 N2O4反应的热化学反应方程式 。
查看答案和解析>>
科目: 来源: 题型:
近年来,乳酸成为研究热点之一。乳酸可以用化学方法合成,也可以由淀粉通过发酵法制备。利用乳酸 ![]() 为原料制成的高分子材料具有生物兼容性,而且在哺乳动物体内或自然环境中都可以最终降解成为二氧化碳和水。乳酸还有许多其他用途。
为原料制成的高分子材料具有生物兼容性,而且在哺乳动物体内或自然环境中都可以最终降解成为二氧化碳和水。乳酸还有许多其他用途。
(1)请写出乳酸分子中官能团的名称 、 。
(2)乳酸能与纯铁粉反应制备一种补铁药物
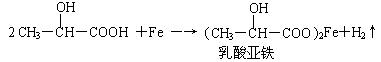
该反应中的还原剂是____________
(3) 乳酸聚合成的纤维非常适合做手术缝合线,其原因是
。
(4)乳酸发生下列变化
![]()
所用的试剂是a ,b (写化学式)
(5)请写出下列反应的化学方程式,并注明反应类型:
①乳酸与乙醇的反应 ;
查看答案和解析>>
科目: 来源: 题型:
X、Y、W、Z是四种常见的短周期元素,其原子
半径随原子序数变化如右图所示。已知X的一种核素的质
量数为18,中子数为10,Y和Ne原子的核外电子总数相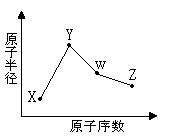
差1;W的单质是一种常见的半导体材料;Z的非金属性在
同周期主族元素中最大。
(1)W位于元素周期表中第 周期第 族
画出X的阴离子的结构示意图 。
(2)Z的氢化物和溴化氢相比,较稳定的是 (写化学式);Z的氢化物
与氟化氢相比,沸点较高的是 (写化学式)。
(3)Y的金属性与Mg的金属性相比, (写化学式)的金属性强,请用实验证明它们金属性的相对强弱: 。
(4)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物发生反应的化学反应方程式 。
查看答案和解析>>
科目: 来源: 题型:
25℃和101kPa时,乙烷、乙炔(C2H2)组成的混合烃32mL与过量的氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,则原混合烃中乙烷的体积分数为( )
A.75% B.12.5% C.50% D.25%
查看答案和解析>>
科目: 来源: 题型:
在一密闭容器中充入1 mol H2和1molI2,压强为p(Pa),并在一定温度下使其发生反应H2(g)+I2(g)=2HI(g) 下列说法正确的是( )
A.保持容器容积不变,向其中加入1molH2,化学反应速率不变
B.保持容器容积不变,向其中加入1molAr,化学反应速率增大
C.保持容器内气体压强不变,向其中加入1molAr,化学反应速率不变
D.保持容器内气体压强不变,向其中加入1 mol H2(g)和1molI2(g),化学反应速率不变
查看答案和解析>>
科目: 来源: 题型:
M、X、Y、Z、W是原子序数依次递增的短周期元素,其中X、Y、Z为同周期元素
且最外层电子数之和为15,X与Z可形成XZ2分子,Y与M形成的气态化合物在标
准状况下的密度为0.76g/L;W的质子数是M、X、Y、Z四种元素质子数之和的1/2。
下列说法正确的是( )
A.原子半径:W >Z >Y >X>M
B.XZ2 、X2M2、W2Z2均为共价化合物
C.元素X与M形成的原子比为1︰1的化合物有多种
D.元素M、X的氯化物中,各原子均满足8电子的稳定结构
查看答案和解析>>
科目: 来源: 题型:
把铝和氧化亚铁配成铝热剂,分为两等份,一份在高温下恰好完全反应,再与盐酸反应。另一份直接放入足量的烧碱溶液中充分反应,前后两种情况下生成的气体的质量比为( )
A.1︰1 B.3︰2 C.2︰3 D.28︰9
查看答案和解析>>
科目: 来源: 题型:
25℃、101kPa下:①2Na(s)+ 1/2O2(g)=Na2O(s) △H= -414kJ·mol-1
②2Na(s)+O2(g)=Na2O2(s) △H= -511kJ·mol-1
下列说法正确的是( )
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.25℃、101kPa下:Na2O2(s)+2Na(s)=2Na2O(s) △H= -317kJ·mol-1
D.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
查看答案和解析>>
科目: 来源: 题型:
下列关于热化学反应方程式的描述正确的是( )
A.HCl和NaOH反应的中和热△H=-57.3kJ·mol-1,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ·mol-1
B.CO(g)的燃烧热是283.0 kJ·mol-1,则2 CO2 (g)= 2CO(g)+O2(g)的反应的
△H=+(2×283.0) kJ·mol-1
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com