
科目: 来源: 题型:
A、B、C、D是四种短周期元素,E、F是过渡元素。A、B、C同周期,C、D同主族, A的原子结构示意图为: 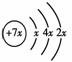 ,B是同周期除稀有气体外半径最大的元素,C的最外层有 三个成单电子,E、F的外围电子排布式分别为3d54s1,3d64s2,回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有 三个成单电子,E、F的外围电子排布式分别为3d54s1,3d64s2,回答下列问题:
(2)、B的最高价氧化物的化学式为 ,C的最低负化合价为 。
(3)、用轨道表示式表示D原子核外电子排布
;
(4)、解释为什么E的外围电子排布式为3d`54s1,而不为3d 44s2 ?
;
(5)、F原子结构示意图是 。
查看答案和解析>>
科目: 来源: 题型:
(1)、下表是一些短周期元素的气态原子失去核外不同电子所需的能量(kJ·mol-1):

通过表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量 ,
X在周期表中位置:第 期, 族,Y的最高正价为 。
(2)1932年美国化学家鲍林(L.Pauling)首先提出了电负性的概念。电负性(用X表示)
也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1. 0 | 1.5] | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
请仔细分析,回答下列有关问题:
①、上表中电负性最小的元素是 (填元素符号),估计钙元素的电负
性的取值范围:__________<X<__________。
②、经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成
的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为______________,其理由是 。
查看答案和解析>>
科目: 来源: 题型:
(1)、配制FeSO4溶液时,常加入少量铁粉,目的是___________________________________;
常加入少量H2SO4,目的是__________________________________________________________。
(2)、泡沫灭火剂包括Al2(SO4)3溶液(约1 mol·L-1)、NaHCO3溶液(约1 mol·L-1)及起泡
剂。使用时发生的化学反应的离子方程式是_____________________________________。
(3)、已知![]() 为难溶于水和酸的白色固体,
为难溶于水和酸的白色固体,![]() 为难溶于水和酸是黑色固体。
为难溶于水和酸是黑色固体。![]() 和
和
水的悬浊液中加入足量的![]() 溶液并振荡,结果白色固体完全转化为黑色固体。
溶液并振荡,结果白色固体完全转化为黑色固体。
①、写出白色固体转化黑色固体的化学方程式: ;
②、白色固体转化成黑色固体的原因是: 。
(4)、已知下列物质在20℃下的Ksp如下,试回答下列问题:
| 化学式 | ① AgCl | ② AgBr | ③ Ag2S | ④ Ag2CrO4 |
| Ksp | 2.0×10-10 | 5.4×10-13 | 2.0×10-48 | 2.0×10-12 |
① 、20℃时,上述四种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是(填序号)
_____________________________。
②、向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,![]() =_______________ 。
=_______________ 。
查看答案和解析>>
科目: 来源: 题型:
在常温下,下列五种溶液:
①0.1mol/L![]() ②0.1mol/L
②0.1mol/L![]() ③0.1mol/L
③0.1mol/L![]()
④0.1mol/L![]() 和0.1mol/L
和0.1mol/L![]() 混合液 ⑤0.1mol/L
混合液 ⑤0.1mol/L![]()
请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)
____________________________________________________________________________。
(2)在上述五种溶液中,![]() 最小的是 ;
最小的是 ;![]() 最小的是 (填序号)
最小的是 (填序号)
(3)比较溶液②、③中![]() 的大小关系是② ③(填“>”、“<”或“=”)。
的大小关系是② ③(填“>”、“<”或“=”)。
(4)在溶液④中, 离子的浓度为0.1mol/L;![]() 和 离子的物
和 离子的物
质的量浓度之和为0.2mol/L。
(5)常温下,测得溶液②的![]() ,则说明
,则说明![]() 的水解程度 (填“>”、“<”
的水解程度 (填“>”、“<”
或“=” )![]() 的水解程度,
的水解程度,![]() 与
与![]() 浓度的大小关系是:
浓度的大小关系是:![]()
![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
下表是周期表的一部分,试回答下列问题

(1)、表中元素中,第一电离能最小的元素是 (填元素符号,下同),电负性最大的元素是 ,单质中化学性质最不活泼的是__________ (填化学式)。
(2)、表中元素的最高价氧化物对应水化物中,酸性最强的是 (填化学式,下同),碱性最强的是 ,呈两性的氢氧化物是 。
(3)、表中ⅦA元素中最不稳定的氢化物是__________(填化学式)。
(4)、为什么表中的④第一电离能比⑤大?
______________________________________________ 。
查看答案和解析>>
科目: 来源: 题型:
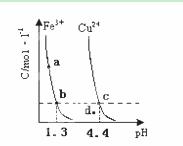
某温度下,将Fe(OH)3(s)、Cu(OH)2(s) 分别置于蒸馏水中达到沉淀溶解平衡后,金属阳离子浓度随溶液![]() 的变化如下图所示。下列判断正确的是( )
的变化如下图所示。下列判断正确的是( )
A.加适量浓NH3·H2O可使溶液由![]() 点变到
点变到![]() 点
点
B.![]()
![]() 两点代表的溶液中
两点代表的溶液中![]() 与
与![]() 乘积不相等
乘积不相等
C.Cu(OH)2在![]() 点比在d点代表的溶液中溶解程度小
点比在d点代表的溶液中溶解程度小
D.该温度下,氢氧化铁的![]()
查看答案和解析>>
科目: 来源: 题型:
已知一种c(H+)=1×10-3mol/L的酸和一种c(OH-)=1×10-3mol/L的碱溶液等体积混合后溶液呈酸性其原因可能是( )
A.生成了一种强酸弱碱盐
B.等浓度的强酸和弱碱溶液反应
C.浓的强酸和稀的强碱溶液反应
D.浓的弱酸和稀的强碱溶液反应
查看答案和解析>>
科目: 来源: 题型:
元素X、Y、Z在周期表中的相对位置如图所示:
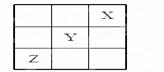
已知Y元素原子的外围电子排布为ns(n-1)np(n+1),则下列说法不正确的是( )
A. X元素所在周期中所含非金属元素最多
B.Y元素在周期表的第3周期ⅥA族
C. Y元素原子的外围电子排布为4s24p4
D.Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3
查看答案和解析>>
科目: 来源: 题型:
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3; ③1s22s22p3; ④1s22s22p5。则下列有关比较中正确的( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>③=②>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com