
科目: 来源: 题型:
X、Y、Z、W、Q 五种元素原子序数依次增大,X原子核外的L层电子数是K层的两倍,Z原子外围电子排布式为nsnnp2n,W原子核外的M层中只有两对成对电子,Q的核电荷数是Z与W的核电荷数之和。请回答下列问题:
(1)X、W的元素符号依次为 、 ;
(2)写出Y2的电子式____________________;
(3)WZ2与XZ2分子的空间结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式);
(4)Q在元素周期表 区(填s、p、d、ds、f),其外围电子排布式为 ,在形成化合物时它的最高化合价为 。
查看答案和解析>>
科目: 来源: 题型:
(1)氮元素基态原子核外未成对电子数为 个;
(2)C、N、O三种元素第一电离能从大到小的顺序是_____________;
(3)某晶体的晶胞如图所示,X位于体心,Y位于4个面心,Z位于
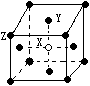 8个顶点,该晶体中 X、Y、Z的粒子个数比为______________;
8个顶点,该晶体中 X、Y、Z的粒子个数比为______________;
(4)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态
电子排布式 ;葡萄糖分子中碳原子杂化方式有 。
(5)某化合物其组成可用CoCl3·5NH3表示。把CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1 mol CoCl3·5NH3只生成2 mol AgCl。请写出表示此配合物结构的化学式(钴的配位数为6)_____________________。
查看答案和解析>>
科目: 来源: 题型:
现有下列物质, 用编号填空回答下列各问题:
A.干冰 B.金刚石 C.氩 D.过氧化钠 E.二氧化硅 F.氯化铵
(1)通过非极性键形成的晶体是 。
(2)固态时属于分子晶体的是 。
(3)由原子构成的分子晶体是 。
(4)含有非极性键的离子化合物是 。
(5)含有离子键、共价键、配位键的化合物是 。
查看答案和解析>>
科目: 来源: 题型:
已知100℃时,0.01mol·L-1 NaHSO4溶液中水电离的c(H+) =10-10 mol·L-1,该温度下将pH=8的Ba(OH)2溶液V1 L与pH=5 V2 L NaHSO4混合,所得溶液pH=7,则 V1∶V2=
A.2∶9 B.1∶9 C.1∶1 D.1∶2
查看答案和解析>>
科目: 来源: 题型:
已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×l0-10 | K1=4.3×10-7 K2=5.6×10-11 |
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,溶液中c(Na+)>c(CN-),则a一定小于b
C.冰醋酸中逐滴加水,则溶液的导电性、n(H+)、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,存在c(Na+)+ c(H+)=c(OH—)+ c(HCO3-) +2c(CO32-)
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是
A.原子晶体中,共价键键能越大,熔沸点越高;
B.同主族金属的原子半径越大,熔点越高;
C.分子晶体中,分子间作用力越大,该分子越稳定;
D.某晶体溶于水中后可电离出自由移动离子,该晶体一定为离子晶体。
查看答案和解析>>
科目: 来源: 题型:
下列有关配合物的论述不合理的是
A.Na[Al(OH) 4]和[Ag(NH3)2]OH都是配合物
B.Na3[AlF6]、Na2[SiF6]和[Cu(NH3)4]Cl2的配位数都是6
C.[ZnCl4]2-的空间构型为正四面体形
D.配合物[Cr(H2O)4Br2]Br·2H2O中,中心离子的化合价为+3价,配离子带1个单位的正电荷
查看答案和解析>>
科目: 来源: 题型:
下列反应的离子方程式正确的是
A.碳酸镁溶于硝酸中:CO32-+2H+ === H2O+CO2↑
B.AlCl3水解反应:Al3+ + 3H2O === Al(OH)3↓ + 3H+
C.向稀氨水中加入稀盐酸:NH3·H2O + H+ === NH4+ + H2O
D.纯碱水解反应:CO32- + 2H2O![]() H2CO3 + 2OH-
H2CO3 + 2OH-
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.冰溶化时,分子中H—O键发生断裂
B.在晶体中只要有阳离子,一定有阴离子
C.离子化合物中可能含有非极性共价键
D.在SiO2晶体中,Si原子与Si—O键数目比为1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com