
科目: 来源: 题型:
可逆反应2NO2 2NO + O2在体积不变的密闭容器中反应,现有以下几种说法:
①反应混合物中各物质的物质的量浓度相等
②单位时间内生成n mol O2 的同时生成2n mol NO2
③用NO2、NO、O2的物质的量浓度变化表示的反应速率比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均摩尔质量不再改变的状态
其中表示达到平衡状态的表述是( )
A.①④ B.②④⑥ C.①②③ D.①②④⑤
查看答案和解析>>
科目: 来源: 题型:
已知C(s)+ CO2(g) 2CO(g)正反应为吸热反应,下列措施能使正反应速率加快的是( )
①增加少量C(s) ②升高温度 ③容器不变,再通入CO2 ④缩小体积增大压强
A.①②③ B.①②③④ C.②③ D. ②③④
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A. 需要加热才能发生的反应一定是吸热反应
B. 放热反应在常温下一定很容易发生
C. 反应是放热还是吸热,可根据反应物和生成物所具有的总能量的相对大小判断
D. 吸热反应在常温下一定不能发生
查看答案和解析>>
科目: 来源: 题型:
将4 mol A和2 molB在2L的密闭容器中混合并在一定的条件下发生如下反应:2A(g)+ B(g)2C(g),经2秒后测得C的浓度为0.6 mol •L-1,现有以下几种说法:
①用物质A表示的该反应的平均反应速率为0.3 mol •L-1• s -1
②用物质B表示的该反应的平均反应速率为0.6 mol •L-1• s -1
③2s时物质B的物质的量的浓度为0.7 mol •L-1
④2s时物质A的转化率为70%
其中表述正确的是( )
A. ①④ B.①③ C.②③ D.③④
查看答案和解析>>
科目: 来源: 题型:
(8分)现有如下两个反应:
A.2NaOH+H2SO4 = Na2SO4+2H2O B.CH4+2O2 = CO2+2H2O
(1)根据反应的本质,两个反应都为 反应(放热或吸热),判断两个反应能否设计为原电池?(填“能或不能”)A B
(2)如果能,最好应选择 作电解质溶液(NaOH或H2SO4)。则负极电极反应式: ,正极电极反应式: 。(若均不能则此问不填)
查看答案和解析>>
科目: 来源: 题型:
(9分)短周期的五种主族元素A、B、C、D、E原子序数依次变小。A的单质在常温下为气态,B、D属于同一主族,C为自然界含量最多的金属元素,D的最外层电子数为次外层的2倍,E为周期表中原子半径最小的元素。
(1)A、B的元素名称分别为 、 。
(2)D、E可以形成多种化合物,其中一种化合物的相对分子质量为28。写出其结构简
式 。
(3)自然界中B元素多以氧化物的形式存在,请写出工业上制取B单质的化学方程式
。
(4)写出实验室制取A气体的化学方程式 。
(5)a克C单质和氧化铁的混合物分为两等份,向其中一份中加入足量NaOH溶液,测得生成气体(标况,下同)体积为mL;另一份在高温下恰好完全反应,将产物冷却后加入足量HCl溶液,测得生成气体体积为nL。则m:n= 。
查看答案和解析>>
科目: 来源: 题型:
(6分)按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应生成正盐时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的热化学方程式_____________________。
(2)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式 。
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
(12分)某自主学习小组用HNO3与大理石反应过程中质量减小的方法,探究影
反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL,大理石用量为10.00g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol·L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和__探究温度对该反应速率的影响; (Ⅲ)实验①和__探究大理石规格(粗、细)对该反应速率的影响。 |
| ② |
|
|
| |
| ③ |
| 粗颗粒 |
| |
| ④ |
|
|
|
(2)实验①中CO2质量随时间变化的关系见下图:依据反应方程式![]() CaCO3+HNO3
CaCO3+HNO3![]() Ca(NO3)2+
Ca(NO3)2+![]() CO2↑+
CO2↑+![]() H2O,计算实验①在70-90 s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
H2O,计算实验①在70-90 s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
(13分)实验探究:探究碳、硅元素的非金属性的相对强弱,根据要求完成下列各小题
(1)实验装置:

填写所示仪器名称A B
(2)实验步骤:
连接仪器、_____________、加药品后,打开a、然后滴入浓硫酸,加热
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是 ;
装置E中足量酸性KMnO4溶液的作用是 ;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是 ;
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性___(填“能”或“否”),试管D中发生反应的离子方程式是 。
查看答案和解析>>
科目: 来源: 题型:
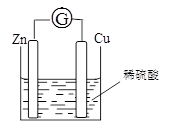
将锌片和铜片用导线相连浸入稀硫酸中组成原电池,两电极间连接一个电流计,装置如图:
(1) 锌片上发生的电极反应: ;
铜片上发生的电极反应: ;
(2)若该电池中两电极的总质量为60g,工作一段时间后,
取出锌片和铜片洗净干燥后称重,总质量为47g,试计算产生标准状况
氢气的体积为多少L?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com