
科目: 来源: 题型:
(8分)从铁、盐酸、氧气、水、碳酸钙五种物质中选出一种或两种作为反应物,按下列要求的反应类型各写一个化学方程式
(1)化合反应
(2)分解反应
(3)置换反应
(4)复分解反应
查看答案和解析>>
科目: 来源: 题型:
(8分)选择下列实验方法分离物质,将分离方法的序号填在横线上
A.萃取分液法 B.加热分解 C.结晶法 D.分液法
E.蒸馏法 F.过滤法
(1) 分离饱和食盐水和沙子的混合物
(2) 从硝酸钾和氯化钠的混合溶液中获得硝酸钾
(3) 分离水和四氯化碳的混合物
(4) 分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃),已知四氯化碳和甲苯互溶。
查看答案和解析>>
科目: 来源: 题型:
(14分)实验室用固体烧碱配制500mL 1 mol/L的NaOH溶液
(1)(4分)需称量 g的烧碱固体,固体应放在 中称量。
(2)(4分)配制过程中除了烧杯还需要哪些仪器
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低或无影响)(4分)
①定容时俯视刻度线 ②容量瓶未干燥
③转移过程中有少量液体溅出
④未洗涤烧杯和玻璃棒
(4)(2分)若定容时液面高于刻度线应采取的措施是
查看答案和解析>>
科目: 来源: 题型:
现有50mL密度为1.18g/mL、质量分数为36.5%的浓盐酸:求
(1)此浓盐酸的物质的量浓度
(2)将此浓盐酸用蒸馏水稀释至200mL,则稀释后盐酸的物质的量浓度为多少?
查看答案和解析>>
科目: 来源: 题型:
对发现元素周期律贡献最大的化学家是( )
A.牛顿 B.道尔顿 C.阿佛加德罗 D.门捷列夫
【解析】考查化学史。牛顿的贡献主要在物理学上。道尔顿提出的是原子学说,阿伏加德罗提出的分子学说,门捷列夫绘制出了第一张元素周期表。所以答案是D。
查看答案和解析>>
科目: 来源: 题型:
原子核外每个电子层上均含有2n2个电子的元素是( )
A.Be B.C C.Ar D.Ne
【解析】考查原子核外电子的运动规律。A、B的L层不满足8个电子,C中的M层不满足18电子,所以正确的答案是D。
查看答案和解析>>
科目: 来源: 题型:
2011年3月,日本福岛核电站由于地震损毁而造成放射性物质泄漏,在我国多地检测出极微量的![]() I,关于
I,关于![]() I的下列说法中正确的是( )
I的下列说法中正确的是( )
A.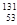 I是放射性核素,应该多吃加碘食盐来预防其对人体的损害
I是放射性核素,应该多吃加碘食盐来预防其对人体的损害
B.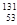 I与
I与![]() I属于碘元素的两种不同核素,互称同素异形体
I属于碘元素的两种不同核素,互称同素异形体
C.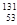 I与
I与![]() I属于同种元素,所以性质完全相同
I属于同种元素,所以性质完全相同
D.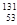 I核内中子数比核外电子数多25个
I核内中子数比核外电子数多25个
【解析】在表示原子的组成时元素符号的左下角表示质子数,左上角表示质量数,因此![]() I的质子数是53,质量数是131,则中子数是131-53=78,所以中子数比核外电子数多78-53=25,选项D是正确的。同素异形体是指同种元素组成的不同单质,B错误。
I的质子数是53,质量数是131,则中子数是131-53=78,所以中子数比核外电子数多78-53=25,选项D是正确的。同素异形体是指同种元素组成的不同单质,B错误。![]() I与
I与![]() I的质量数不同,属于不同的核素,C不正确。食盐加碘是原来预防甲状腺肿大的,A不正确。答案是D。
I的质量数不同,属于不同的核素,C不正确。食盐加碘是原来预防甲状腺肿大的,A不正确。答案是D。
查看答案和解析>>
科目: 来源: 题型:
在化学变化过程中,原子中的下列粒子数可能发生改变的是( )
A.质子数 B.中子数 C.质量数 D.电子数
【解析】在化学变化过程中,中子数和质子数是不变的,则质量数也不变。而在化学反应中电子数是可以发生变化的。答案选D。
查看答案和解析>>
科目: 来源: 题型:
元素周期表对工农业生产具有一定的指导作用,下列说法不正确的是( )
A.用于制农药的元素通常位于周期表的右上角
B.半导体材料在金属元素和非金属元素的分界线附近
C.在过渡元素中可以找到新型催化剂
D.在IA族元素中寻找新型耐高温、耐腐蚀的材料
【解析】考查元素周期表的应用。在过渡元素中寻找新型耐高温、耐腐蚀的材料,所以选项D是错误的,答案是D。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com