
科目: 来源: 题型:阅读理解
(Ⅰ)氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用。
(1)一定温度下,在1L容积恒定的密闭容器中充入2molN2和8mol H2并发生反应。10min达平衡,测得氨气的浓度为0.4mol/L,此时氮气的转化率为 。
(2)下图是1mol NO2(g)和1molCO(g)反应生成1mol CO2(g)和1mol NO(g)过程中能量变化示意图,请写出该反应的热化学方程式 。
(3)NH3(g)燃烧的方程式4NH3(g)+7O2(g)==4NO2(g)+6H2O(l),
已知:2H2(g)+O2(g)==2H2O(l)△H= -483.6 kJ/mol
N2(g)+2O2(g)==2NO2(g) △H=+67.8 kJ/mol
N2(g)+3H2(g)==2NH3(g) △H=-92.0 kJ/mol
请计算NH3(g)的燃烧热 。
| 温度 | 平衡浓度/ (mol L-1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 |
|
| T2 |
| 0.1 |
(4)将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:
H2NCOONH4(s)![]() 2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见右表。下列说法正确的是
2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见右表。下列说法正确的是
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,H2NCOONH4转化的Δn(T2)=2Δn(T1)
(Ⅱ)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |
|
|
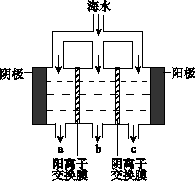 电渗析法淡化海水示意图如下图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
电渗析法淡化海水示意图如下图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
(1)阳极主要电极反应式是 。
(2)在阴极附近产生少量白色沉淀,其成分有 和CaCO3,生成CaCO3的离子方程
式是 。
(3)淡水的出口为 (填“a”、“b”或“c”)。
查看答案和解析>>
科目: 来源: 题型:
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
⑴制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:
__________________________________________________________________。
⑵装置B中饱和食盐水的作用是_______________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象______________________________。
⑶装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入_______。
|
| a | b | c | d |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
⑷设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为______色,说明氯的非金属性大于溴。
⑸打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是_____________。
⑹有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:
______________________,判断改用NaHSO3溶液是否可行______(填“是”或“否”)。
查看答案和解析>>
科目: 来源: 题型:
15分)普通纸张的成分是纤维素,在早期的纸张生产中,常采用纸表面涂敷明矾的工艺,以填补其表面的微孔,防止墨迹扩散,请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存。经分析检验,发现酸性腐蚀主要与造纸中涂敷明矾的工艺有关,其中的化学原理是______。为防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的化学(离子)方程式为______。
(2)为了保护这些纸质文物,有人建议采取下列措施:
①喷洒碱性溶液,如稀氢氧化钠溶液或氨水等,这样操作产生的主要问题是______。
②喷洒Zn(C2H5)2。Zn(C2H5)2可以与水反应生成氧化锌和乙烷。用化学(离子)方程式表示该方法生成氧化锌及防止酸性腐蚀的原理______。
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾,钛白粉的一种工业制法是以钛铁矿主要成分(FeTiO3)为原料按下过程进行的,请完成下列化学方程式
查看答案和解析>>
科目: 来源: 题型:
(15分)血红素中含有C、O、N、Fe五种元素。回答下列问题:
⑴C、N、O、H四种元素中电负性最小的是 (填元素符合),写出基态Fe原子的核外电子排布式 。
⑵下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。血红素中N原子的杂化方式有 ,在右图的方框内用“→”标出Fe2+的配位键。
⑶NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
⑷N与H形成的化合物肼(N2H4)可用作火箭燃料,燃烧时发生的反应是:
![]()
![]()
若该反应中有4molN—H键断裂,则形成的 键有___________mol。
键有___________mol。
⑸根据等电子原理,写出CN—的电子式 , 1 mol O22+中含有的π键数目为 。
⑹铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 。
查看答案和解析>>
科目: 来源: 题型:
(15分)合成纤维Z的吸湿性接近于棉花。合成Z的流程图如下所示:
已知:下列反应中R、R′、R″代表烃基
(1)A的结构简式是 。
(2)B的分子式为C2H4O,其官能团的名称是 。
(3)反应①的化学方程式是 。
(4)下列说法正确的是 。
| a.D→E的反应类型为消去反应 | b.D能与Na、NaOH、NaHCO3反应 |
| c.Q是一种水溶性很好的高分子化合物 | d.G在酸性或碱性环境中均能水解 |
(5)E有多种同分异构体,与E具有相同官能团的有 种(含顺反异构体),其中核
磁共振氢谱有3组吸收峰,且能发生银镜反应的结构简式是 。
(6)合成纤维Z含有六元环状结构, Z的结构简式是 。
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.二氧化锰具有强氧化性,可用作H2O2分解的氧化剂
B.二氧化硫和氯水均具有漂白性,两者混合使用将增强漂白效果
C.在盛放食品的包装袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质
D.锌与稀硫酸反应时加入几滴硫酸铜溶液可加快反应速率,原因是硫酸铜作催化剂
查看答案和解析>>
科目: 来源: 题型:
用NA表示阿伏加德罗常数,下列说法中正确的是
A.18g重水(2H216O)含有的电子数为10NA
B.3.4 g氨气分子中含有0.6NA个N—H键
C.22.4L的NH3和16gCH4中所含有的电子数都是10NA
D.1molFeCl3完全转化为Fe(OH)3胶体后生成NA个胶粒
查看答案和解析>>
科目: 来源: 题型:
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
查看答案和解析>>
科目: 来源: 题型:
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M,关于该反应的说法中正确的组合是
①氧化剂是H3AsO3 ②Sn Cl62-是氧化产物 ③每生成7.5 g As,还原剂失去的电子为0.3mol ④M为OH-
A.①②③ B.①②④ C.①③④ D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com