
科目: 来源: 题型:
(10分)含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO![]() 还原为N2,从而消除污染。其反应的离子方程式是:
还原为N2,从而消除污染。其反应的离子方程式是:
6NO![]() +10Al+18H2O→3N2↑+10Al(OH)3+6OH-
+10Al+18H2O→3N2↑+10Al(OH)3+6OH-
(1)上述反应中,生成标准状况下33.6L氮气时,转移韵电子为 mol。现在要除去1m3含氮元素0.3mol的废水中的N0![]() (设氮元素都以NO
(设氮元素都以NO![]() 的形式存在,下同),则至少需要消耗金属铝 g。
的形式存在,下同),则至少需要消耗金属铝 g。
(2)有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同,。
①写出镁和含氮废水反应的离子方程式
②已知金属镁可以从海水中提取的MgCI2通过电解制得的,电解熔融氯化镁的化学方程式为 ,若要除去1m3含氮元素0.3mol的废水中的NO![]() ,则至少需要含0.5%(质量分数)MgCl2的海水 kg。
,则至少需要含0.5%(质量分数)MgCl2的海水 kg。
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.明矾和漂白粉常用于水处理,两者的作用原理相同
B.利用潮汐发电是将化学能转化为电能
C.铝合金的大量使用是因为人们能用焦炭等还原剂从氧化铝中获取铝
D.2009年12月中旬在哥本哈根召开的国际气候会议受到全球政要的广泛关注,减少工业生产大量排放二氧化碳等温室气体以抑制全球气候变暖成为该会议的主题
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是( )
A.NaHCO3与石灰水反应,当n(NaHCO3)∶n[Ca(OH)2] = 1∶1时,HCO3-完全转化为CaCO3
B.CO2通入石灰水中,当n(CO2)∶n[Ca(OH)2] = 1∶1时,能得到澄清溶液
C.AlCl3溶液与烧碱溶液反应,当n(OH-)∶n(Al3+) = 1∶1时,铝元素以AlO2-形式存在
D.Fe与稀硝酸反应,当n(Fe)∶n(HNO3) = 1∶1时,溶液中铁元素只以Fe3+形式存
查看答案和解析>>
科目: 来源: 题型:
下列实验能达到预期目的的是( )
| 编号 | 实验内容 | 实验目的 |
| A. | 将SO2通入溴水,溴水褪色后加热观察能否恢复原色 | 验证SO2漂白的可逆性 |
| B. | 将氯水加入淀粉KI溶液中 | 验证Cl的非金属性比I强 |
| C. | 把铁块和铜块用导线连接插入浓硝酸中 | 组成原电池验证Fe比Cu活泼 |
| D. | 加热氯化铵和碘单质的固体混合物 | 分离除去碘单质 |
查看答案和解析>>
科目: 来源: 题型:
由部分短周期元素形成的单质或氧化物之间有以下关系
单质X + 氧化物M![]() 氧化物N
氧化物N
单质Y + 氧化物M![]() 单质X+ 氧化物R
单质X+ 氧化物R
单质X + 氧化物Z![]() 单质D+ 氧化物N
单质D+ 氧化物N
若X为非金属单质,则组成Y单质的元素在周期表的位置是
A.第二周期ⅣA族 B.第二周期ⅥA族
C.第三周期ⅡA族 D.第三周期ⅣA族
查看答案和解析>>
科目: 来源: 题型:
被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在另一边镀二氧化锰。在纸内是离子“流过”水和氧化锌组成的电解液。电池的总反应为
Zn + 2MnO2 +H2O = ZnO + 2MnO(OH)。下列说法正确的是( )
A.该电池的正极为锌
B.该电池的反应中二氧化锰起催化作用
C.当0.1mol Zn完全溶解时,流经电解液的电子个数约为1.204×1023
D.电池的正极反应式为:2MnO2 + 2H2O + 2e-= 2MnO(OH) + 2OH-
查看答案和解析>>
科目: 来源: 题型:
工业上制备纯硅的热化学反应方程式为:SiCl4(g) + 2H2(g)Si(s) + 4HCl(g);△H = + Q kJ/mol(Q>0),一定温度、压强下,将一定量的反应物充入密闭容器中进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高硅的产率
B.若反应开始时H2为2 mol,则达到平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl的浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液中能恰好完全反应
查看答案和解析>>
科目: 来源: 题型:
有下列六种转化途径,某些反应条件和产物已省略,下列有关说法正确的是( )

![]() 途径①
途径①
途径②
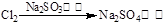 途径③
途径③
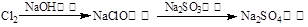 途径④
途径④
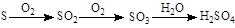
![]() 途径⑤
途径⑤
途径⑥
A.由途径①和②分别制取1 mol FeCl2,理论上各消耗1 mol Fe,各转移2 mol e-
B.由途径③和④分别制取1 mol Na2SO4,理论上各消耗1 mol Cl2,各转移2 mol e-
C.由途径⑤和⑥分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol e-
D.以上说法都不正确
查看答案和解析>>
科目: 来源: 题型:
常温时,有浓度均为0.1 mol/L的四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水,下列有关说法不正确的是( )
A.上述溶液中,既能与NaOH反应,又能与H2SO4反应的溶液中离子浓度由大到小的顺序为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
B.向④中加入少量的NH4Cl固体,此时溶液中c(NH4+)/c(OH-)的值增大
C.若将③和④的溶液混合后,溶液恰好呈中性,则混合前溶液的体积为③<④
D.取10 mL溶液③,加水稀释到100 mL,此时溶液中由水电离的c(H+) = 1×10-12mol/L
查看答案和解析>>
科目: 来源: 题型:
(13分)钛(Ti)被称为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:
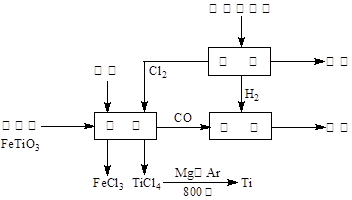
(1)电解饱和食盐水时,阳极的电极反应为 。
(2)写出钛铁矿与焦炭、Cl2共热制得四氯化钛的化学方程式________________________。
(3)已知:①Mg(s) + Cl2(g)=MgCl2(s);△H = – 641 kJ/mol
②Ti(s) +2Cl2(g)=TiCl4(s);△H = –770 kJ/mol
则2Mg(s) + TiCl4(s)=2MgCl2(s) + Ti(s);△H= 。
反应2Mg(s) + TiCl4(s)![]() 2MgCl2(s) + Ti(s),在Ar气氛中进行的理由是 。
2MgCl2(s) + Ti(s),在Ar气氛中进行的理由是 。
(4)在上述产业链中,合成96 t 甲醇理论上消耗H2 t(不考虑生产过程中物质的任何损失)。
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH + 3O2 + 4OH-=2CO32-+ 6H2O。该燃料电池发生反应时正极区溶液的pH (填“增大”、“减小”或“不变”),该电池中负极上的电极反应是________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com