
科目: 来源: 题型:
蓄电池是一种可反复充电、放电的装置。它放电时起原电池的作用,将化学能转变为电能;而充电时电解池的作用,将电能转 变为化学能贮存起来。某蓄电池充电和放电时发生的反应为: Fe + NiO2+ 2H2O Fe(OH)2 + Ni(OH)2
关于此蓄电池下列说法中, 错误的是:( )
① 放电时,NiO![]() 为正极;
为正极;
② 充电时,阳极反应式为:Fe(OH)![]() +2e-=Fe+2OH
+2e-=Fe+2OH![]() ;
;
③放电时,电解质溶液中的阳离子向正极方向移动;
④充电时,Ni(OH)2的反应式为:Ni(OH)2-2e-=NiO![]() +2H
+2H![]() ;
;
⑤该蓄电池的电极必须浸在碱性电解质溶液中;
A. ③ B.② C. ②和④ D. ①③⑤
查看答案和解析>>
科目: 来源: 题型:
相同质量的铁与足量的稀H2SO4及足量的CuO制单质铜,有人设计以下两种方案:
①Fe H2
Cu, ②CuO
CuSO4
Cu。
若实验过程中,根据一般的实验方法和实验操作规则进行操作,则两者制得单质铜的量作比较正确的是( )
A. 相等 B.①多 C.②多 D.无法判断
查看答案和解析>>
科目: 来源: 题型:
下列事实不能用勒夏特列原理(平衡移动原理)解释的是( )
①氯化铁溶液加热蒸干最终得不到氯化铁固体;
②铁在潮湿的空气中容易生锈;
③实验室可用排饱和食盐水的方法收集氯气;
④保存FeCl2溶液时向溶液中加入少量铁粉
⑤钠与氯化钾共融制备钾Na(L)+KCl(L)K(g)+NaCl(L);
⑥二氧化氮与四氧化二氮的平衡体系,加压缩小体积后颜色加深
A.①②③ B.②④⑥ C.③④⑤ D.②⑤⑥
查看答案和解析>>
科目: 来源: 题型:
已知氯化铁溶液中通入硫化氢可发生反应: 2FeCl3+H2S = 2FeCl2+S↓+2HCl 。
在标准状况下,向100mLFeCl3溶液中通入a L的H2S气体后,再加入足量的铁粉充分反应。所得溶液经测定金属阳离子的浓度为3mol/L,若反应过程中溶液体积不变,则原FeCl3溶液的物质的量浓度为 ( )
A.2mol/L B.1.5mol/L C.1 mol/L D.无法确定
查看答案和解析>>
科目: 来源: 题型:
(8分)某溶液仅含下表离子中的5种(不考虑水的电离及离子的水解,且各种离子物质的量均为0.1mol。
①若向溶液中加入KSCN溶液无明显变化;
②若向原溶液中加入稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,且溶液中阴离子种类不变; 请推断:
(1)原溶液中含有阴离子: ;含有阳离子: ;
(2)向原溶液中加入足量稀盐酸发生反应的离子方程式: ;
(3)若向原溶液中加入足量NaOH溶液,充分反应后过滤,洗涤沉淀并灼烧至恒重,
得到的固体质量为 g。
查看答案和解析>>
科目: 来源: 题型:
(10分)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分 子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式__________________________。
(2)若溶液M由10mL 2 mol·L-1NaHA溶液与10mL 2mol·L-1NaOH溶液混合而得,则溶液M的pH ________7 (填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为 。(溶液混合时体积变化忽略,下同)
(3)已知Ksp(BaA)= 1.8×10-10,向⑵的混合溶液中加入10mL 1mol·L-1 BaCl2溶液,混合后溶液中的Ba2+浓度为___________ mol·L-1。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为___________(填“大于、等于、小于”或“均有可能”)。
查看答案和解析>>
科目: 来源: 题型:
(12分)为了证明CO具有还原性,有人利用下列装置设计了系列的实验,其中A为气体发生装置,C为尾气处理装置,X装置可以盛放不同的试剂重复使用。已知草酸与浓硫酸共热发生如下反应:
(1)若以草酸.浓硫酸为原料制备一氧化碳,则该气体发生装置中所用到的玻璃仪器除了
导管、分液漏斗外,还有______________________________。
(2)装置连接无误,装入药品后,在加热装置B之前应进行的一步操作是__________,C中尾气的的处理方法是______________________________。
(3)已知B中固体为CuO,现要制得纯净干燥的CO以验证其还原性,则A.B之间放置的X装置(可重复)中所装试剂依次为:____________________,澄清石灰水,____________________,证明CO具有还原性的现象为____________________。
(4)除上述现象外,若再用一次X装置,还有一种能说明CO具有还原性的现象,
则装置X的安装位置及所装试剂为:______________,现象为:___________________。
查看答案和解析>>
科目: 来源: 题型:
(12分)下图表示各物质之间的转化关系,已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
请按要求填空:
(1)写出物质的的化学式:D_______________,J_______________。
(2)写出反应④的化学方程式_________________________________________。
(3)写出通过上图实验生成E的电极反应式_______________________________。
(4)反应③中若转移1 mol电子,则生成F在标准状况下的体积为_____________。
(5)在上述①~⑥反应中,有水参加反应且水分子既不是氧化剂又不是还原剂的反应有_______。(填写序号)
查看答案和解析>>
科目: 来源: 题型:
(10分)在某温度下、容积均为1L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:
2SO2(g)+O2(g)![]() 2SO3(g) △H=-196kJ/mol。
2SO3(g) △H=-196kJ/mol。
初始投料与各容器达到平衡时的有关数据如下:
(1)若初始投入a molSO2、b molO2和c molSO3,在相同条件下,要达到与甲相同的化学平衡,则a、c间应满足的代数关系式为_________;b、c间应满足的代数关系式为 _________。
(2)该温度下此反应的平衡常数值为______________,若在相同温度条件下起始投入 0.1molSO2、0.1molO2、0.3molSO3,则反应开始时正逆反应速率的大小关系是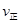 _______
_______![]()
(3)三个容器中的反应分别达平衡时各组数据关系正确的是_______________
A.α1+α2=1 B.Q1+Q2=196
C.α3<α1 D.P3<2P1=2P2
E.n2<n3<3.2mol F.Q3=2Q1
(4)如图表示甲反应在t1时刻达到化学平衡,在t2时因改变某个条件而发生变化的情况, 则t2时刻改变的条件可能是_____________________。
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的
B.海洋经济专属区的资源开发可获得Na、Ca、K、Mg、B等金属
C.电解MgCl2饱和溶液,可制得金属Mg
D.从海带中提取碘单质的过程不涉及氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com