
科目: 来源: 题型:
下列离子方程式书写正确的是
A.向Na2S2O3溶液中通入足量的氯气:S2O32-+ Cl2 +3H2O==2SO32-+4Cl-+6H+
B.氯气与水反应:Cl2+H2O2H++Cl-+ClO-
C.氢氧化钠溶液跟过量碳酸氢钙溶液反应:Ca2++HCO3-+OH-===CaCO3↓+ H2O
D.氯化铝溶液中加入过量的氨水:Al3+ + 3NH3·H2O= Al(OH)3↓+ 3 NH4+
查看答案和解析>>
科目: 来源: 题型:
在某无色透明的溶液中,能大量共存的离子组是
A.Na+ 、K+、SO42-、HCO3-
B. Ba2+、K+、CO32-、NO3-
C.I-、 H+、Cl-、 NO3-
D.Al3+、K+、SO42-、ClO-
查看答案和解析>>
科目: 来源: 题型:
下列化学实验事实及其结论都正确的是
A.铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝熔点高于铝
B.将SO2通入含HClO的溶液中,生成H2SO4,说明HClO酸性比H2SO4强
C.FeCl3溶液可以腐蚀线路板上的Cu,说明Fe的金属活动性大于Cu
D.将饱和氯水滴到淀粉碘化钾试纸上,试纸先变蓝后变白,说明氯水具有漂白性
查看答案和解析>>
科目: 来源: 题型:
近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:。下列有关说法正确的是
A. 电解时,石墨作阴极,不锈钢作阳极
B. 电解时,阳极反应是:I –– 6e – + 3H2O = IO3 –+ 6H+
C. 溶液调节至强酸性,对生产有利
D. 电解前后溶液的pH几乎不变
查看答案和解析>>
科目: 来源: 题型:
常温下pH=3的二元弱酸H2R溶液与a L pH=11的NaOH溶液混合后,混合液的pH刚好等于7(假设反应前后体积不变),则对反应后混合液的叙述正确的是
A. c(R2-)+ c(OH-)=c(Na+)+c(H+)
B. c(R2-)>c(Na+)>c(H+)=c(OH-)
C. 2c(R2-)+ c(HR-)=c(Na+)
D. 混合后溶液的体积为2a L
查看答案和解析>>
科目: 来源: 题型:
(8分)近年来,我国研究储氢碳管获得重大进展,用电弧法合成碳纳米管,常伴有大量碳纳米颗粒生成,这种碳纳米颗粒可用氧化气化法除去,其反应的化学方程式为:
_ C +__ _K2Cr2O7+_ _H2SO4(稀 ) → __ _CO2+_ _K2SO4+ Cr2(SO4)3+ _ ___
(1)此反应的氧化剂_ ▲ ___,还原剂__ ▲ ___
(2)硫酸在上述反应中表现出的性质是__ ▲ _____(填选项编号)
A.酸性 B.氧化性 C.吸水性 D.脱水性
(3)上述反应若产生11克气体物质,则转移电子的数目_ ▲ ______
查看答案和解析>>
科目: 来源: 题型:
(20分)MnO2是一种重要的功能无机材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(只含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
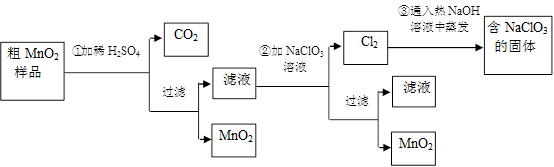
(1)第①步加稀H2SO4时,将粗MnO2样品中 ▲ ,▲ (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是(补充完整并配平): Mn2+ + ClO3—+ = MnO2↓+ Cl2↑+ ;
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、 ▲ 、 ▲ 、玻璃棒。
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224LCO2(标准状况下),则在第①步反应中至少需要▲ mol H2SO4。写出计算过程 (已知摩尔质量:MnO2 -87g/mol; MnO-71g/mol; MnCO3-115g/mol)
(5)已知2H2O2(l)=2H2O(l)+O2(g) △H=a kJ·mol-1 反应过程的能量变化如图所示。则
① 该反应为 ▲ 反应(填“吸热”或“放热”)。
②请用虚线在右图中画出使用MnO2作催化剂的情况下反应过程中体系能量变化示意图。

查看答案和解析>>
科目: 来源: 题型:
(14分)为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
【探究一】
(1)常温下,工业上用铁质容器盛放冷的浓硫酸,其原因是 ▲
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
① 甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用 ▲ (选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
② 乙同学取560mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O===2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为 ▲ 。
【探究二】
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893g·L-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。
(3)装置B中试剂的作用是 ▲
(4)分析Y气体中的Q2气体是如何生成的 ▲ (用化学方程式表示)。
(5)为确认Q2的存在,需在装置中添加洗气瓶M于 ▲ (选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是 ▲
查看答案和解析>>
科目: 来源: 题型:
(10分)燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为 ▲ 。
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g) + 6H2(g) CH3OCH3(g)+ 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时, CO2的转化率见下表:
| 投料比[n(H2) / n(CO2)] | 500 K | 600 K | 700 K | 800 K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37%[ | 22% |
①若温度升高,则反应的平衡常数K将 ▲ (填“增大”、“减小”或“不变”。下同);若温度不变,提高投料比[n(H2) / n(CO2)],则K将 ▲ 。
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式 ▲ 。
③在②所确定的电池中,若通入甲醚(沸点为-24.9 ℃)的速率为1.12 L·min-1(标准状况),并以该电池作为电源电解2 mol·L-1 CuSO4溶液500 mL,则通电30 s后理论上在阴极可析出金属铜 ▲ g。
查看答案和解析>>
科目: 来源: 题型:
(12分)某兴趣小组对如何延长硫酸亚铁溶液的保质期展开了研究。
⑴制备硫酸亚铁溶液,最合适的试剂组为 ▲ (填编号);
a.过量铁屑和稀硫酸 b.过量稀硫酸和铁屑 c.过量硫酸铁溶液和铁屑
⑵实验室保存硫酸亚铁溶液的一般方法是__________▲ ___________________;
该兴趣小组取等体积的硫酸亚铁溶液分别加入三个烧杯中,各滴入3 滴KSCN试剂,然后进行如下实验:
| 烧杯编号 | ① | ② | ③ |
| 加入试剂 | 铁粉0.1g | 铁粉0.1g,0.1mol/LH2SO43mL | 0.1mol/LH2SO43mL |
| 红色出现时间(天) | 1天 | 4天左右 | 8天以上 |
⑶在烧杯②中加入2种试剂后,即可观察到的现象为 ▲ ;
⑷通过比较上述3组实验,可以得出的结论为 ▲ ;
⑸硫酸亚铁溶液在空气中易氧化,氧化产物易水解生成Fe(OH)3,导致溶液酸性增大。
① 试用一个离子方程式表示上述反应过程中的变化 ▲ ;
②硫酸亚铁溶液在空气中变质的反应为可逆反应,试用化学平衡理论解释烧杯③出现红色最晚的原因 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com