
科目: 来源: 题型:
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
下列叙述正确的是 ( )
A.X、Y元素的金属性 X<Y
B.一定条件下,Z单质与W的常见单质直接生成2W2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
查看答案和解析>>
科目: 来源: 题型:
现有M、N、P、E 4种元素的单质,能发生以下反应:
①在水溶液中,M+N2+ M2++N ②P+2H2O(冷)
P(OH)2+H2↑ ③N、E相连浸入稀H2SO4中,电极反应为:N-2e-
N2+,2H++2e-===H2↑
判断它们的还原性由强到弱的顺序是 ( )
A.M、N、P、E B.P、M、N、E
C.M、N、E、P D.E、P、M、N
查看答案和解析>>
科目: 来源: 题型:
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e-=4OH-
C.每转移0.1 mol电子,消耗1.12 L的H2
D.H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目: 来源: 题型:
阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为
下列说法正确的是
A.可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成
B.香兰素、阿魏酸均可与NaHCO3、NaOH溶液反应
C.通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
D.与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有2种
查看答案和解析>>
科目: 来源: 题型:
已知H2(g)+Br2(l)=2HBr(g) △H=-72kJ/mol. 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
则表中a为
A.404 B.260 C.230 D.200
查看答案和解析>>
科目: 来源: 题型:
将质量分数为0.052(5.2%)的NaOH溶液1 L(密度为1.06 g/cm3),用铂作电极电解,当溶液中NaOH的质量分数改变了0.010(1.0%)时停止电解,此时溶液中符合下表关系的是( )
|
| NaOH的 质量分数 | 阳极析出 物质的质量/g | 阴极析出物 质的质量/g |
| A | 0.062(6.2%) | 19 | 152 |
| B | 0.062(6.2%) | 152 | 19 |
| C | 0.042(4.2%) | 1.2 | 9.4 |
| D | 0.042(4.2%) | 9.4 | 1.2 |
查看答案和解析>>
科目: 来源: 题型:
下列热化学方程式或离子方程式中,正确的是:
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:有CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:
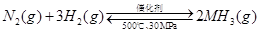 △H=-38.6kJ·mol-1
△H=-38.6kJ·mol-1
C. 氯化镁溶液与氨水反应:![]()
D. 氧化铝溶于NaOH溶液:![]()
查看答案和解析>>
科目: 来源: 题型:
某钠盐溶液中可能含有![]() 等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
①用pH计测得溶液pH大于7
②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色。
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)溶液,再滴加KSCN溶液,显红色
该同学最终确定在上述六种离子中只含![]() 三种阴离子。
三种阴离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
A. ①②④⑤ B.③④ C.③④⑤ D. ②③⑤
查看答案和解析>>
科目: 来源: 题型:
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知:A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍;E在同周期元素中原子半径最小。
(1)A2B和A2D的沸点较高者是 (填化学式),其原因是 ;
(2)用多孔的石墨电极电解滴有酚酞的C和E形成的化合物的饱和溶液。接通电源一段时间后, 极(填电极名称)附近出现红色;另一极的电极反应式为 ,可用 检验该极所得产物。电解的总反应方程式为 。
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题:
⑴ L的元素符号为________ ;M在元素周期表中的位置为________;五种元素的原子半径从大到小的顺序是_______________(用元素符号表示)。
⑵ Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
⑶ 硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1 b.+29.7 mol·L-1 c.-20.6 mol·L-1
d.-241.8 kJ·mol-1
⑷ 用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q 。写出阳极生成R的电极反应式:______________;由R生成Q的化学方程式:___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com